convertoare catalitice
convertoarele catalitice schimbă molecule otrăvitoare precum monoxidul de carbon și diferiți oxizi de azot din evacuările auto în molecule mai inofensive, cum ar fi dioxidul de carbon și azotul. Ei folosesc metale scumpe precum platina, paladiul și rodiul ca catalizator eterogen.
metalele sunt depozitate sub formă de straturi subțiri pe un fagure ceramic. Acest lucru maximizează suprafața și menține cantitatea de metal utilizată la minimum.
luând reacția dintre monoxidul de carbon și monoxidul de azot ca fiind tipică:
![]()
![]()
convertoarele catalitice pot fi afectate de otrăvirea cu catalizator. Acest lucru se întâmplă atunci când ceva care nu face parte din reacție devine foarte puternic adsorbit pe suprafața catalizatorului, împiedicând reactanții normali să ajungă la el.
plumbul este o otravă catalizatoare familiară pentru convertoarele catalitice. Acoperă fagurele de metale scumpe și îl oprește să funcționeze.
în trecut, compușii de plumb au fost adăugați la benzină (benzină) pentru a face să ardă mai ușor în motor. Dar nu puteți utiliza un convertor catalitic dacă utilizați combustibil cu plumb. Astfel, convertoarele catalitice nu numai că au ajutat la eliminarea gazelor otrăvitoare, cum ar fi monoxidul de carbon și oxizii de azot, dar au forțat și eliminarea compușilor otrăvitori de plumb din benzină.
utilizarea oxidului de vanadiu(V) în procesul de Contact
în timpul procesului de Contact pentru fabricarea acidului sulfuric, dioxidul de sulf trebuie transformat în trioxid de sulf. Acest lucru se realizează prin trecerea dioxidului de sulf și a oxigenului peste un catalizator solid de oxid de vanadiu(V).
![]()
![]()
acest exemplu este ușor diferit de cele anterioare, deoarece gazele reacționează efectiv cu suprafața catalizatorului, schimbându-l temporar. Este un bun exemplu al capacității metalelor de tranziție și a compușilor lor de a acționa ca catalizatori datorită capacității lor de a-și schimba starea de oxidare.
dioxidul de sulf este oxidat în trioxid de sulf de oxidul de vanadiu(V). În acest proces, oxidul de vanadiu(V) este redus la oxid de vanadiu(IV).
![]()
![]()
oxidul de vanadiu (IV) este apoi reoxidat de oxigen.
![]()
![]()
acesta este un bun exemplu al modului în care un catalizator poate fi schimbat în timpul unei reacții. La sfârșitul reacției, totuși, va fi chimic la fel cum a început.
cataliză omogenă
aceasta are catalizatorul în aceeași fază cu reactanții. De obicei, totul va fi prezent ca gaz sau conținut într-o singură fază lichidă. Exemplele conțin unul din fiecare dintre acestea . . .
Exemple de cataliză omogenă
reacția dintre ionii de persulfat și ionii de iodură
aceasta este o reacție de soluție pe care o puteți întâlni doar în contextul catalizei, dar este un exemplu minunat!
ionii de persulfat (ionii de peroxodisulfat), S2O82-, sunt agenți oxidanți foarte puternici. Ionii de iodură sunt foarte ușor oxidați în iod. Și totuși reacția dintre ele în soluție în apă este foarte lentă.
dacă vă uitați la ecuație, este ușor să vedeți de ce este:
![]()
![]()
reacția are nevoie de o coliziune între doi ioni negativi. Repulsia va deveni serios în calea asta!
reacția catalizată evită complet această problemă. Catalizatorul poate fi fier(II) sau fier (III) ioni care se adaugă la aceeași soluție. Acesta este un alt bun exemplu de utilizare a compușilor metalelor de tranziție ca catalizatori datorită capacității lor de a schimba starea de oxidare.
de dragul argumentului, vom lua catalizatorul pentru a fi ioni de fier (II). După cum veți vedea în scurt timp, nu contează de fapt dacă utilizați ioni de fier(II) sau fier(III).
ionii de persulfat oxidează ionii de fier(II) în ioni de fier(III). În acest proces, ionii de persulfat sunt reduși la ioni de sulfat.
![]()
![]()
ionii de fier (III) sunt agenți oxidanți suficient de puternici pentru a oxida ionii de iodură în iod. În acest proces, acestea sunt reduse din nou la ioni de fier(II).
![]()
![]()
ambele etape individuale ale reacției globale implică coliziunea dintre ionii pozitivi și negativi. Acest lucru va fi mult mai probabil să aibă succes decât coliziunea dintre doi ioni negativi în reacția necatalizată.
ce se întâmplă dacă folosiți ioni de fier(III) ca catalizator în loc de ioni de fier(II)? Reacțiile se întâmplă pur și simplu într-o ordine diferită.
distrugerea ozonului atmosferic
acesta este un bun exemplu de cataliză omogenă în care totul este prezent ca gaz.
ozonul, O3, este în mod constant format și rupt din nou în atmosfera înaltă prin acțiunea luminii ultraviolete. Moleculele obișnuite de oxigen absorb lumina ultravioletă și se sparg în atomi individuali de oxigen. Aceștia au electroni nepereche și sunt cunoscuți sub numele de radicali liberi. Sunt foarte reactivi.
![]()

radicalii de oxigen se pot combina apoi cu moleculele obișnuite de oxigen pentru a produce ozon.
![]()
![]()
ozonul poate fi, de asemenea, împărțit din nou în oxigen obișnuit și un radical de oxigen prin absorbția luminii ultraviolete.
![]()
![]()
această formare și descompunere a ozonului se întâmplă tot timpul. Luate împreună, aceste reacții opresc o mulțime de radiații ultraviolete dăunătoare care pătrund în atmosferă pentru a ajunge la suprafața Pământului.
reacția catalitică de care suntem interesați distruge ozonul și astfel îl oprește să absoarbă UV în acest fel.
clorofluorocarburile (CFC) precum CF2Cl2, de exemplu, au fost utilizate pe scară largă în aerosoli și ca agenți frigorifici. Descompunerea lor lentă în atmosferă produce atomi de clor-radicali liberi de clor. Acestea catalizează distrugerea ozonului.
acest lucru se întâmplă în două etape. În primul rând, ozonul este rupt și se produce un nou radical liber.
![]()
![]()
catalizatorul radical al clorului este regenerat printr-o a doua reacție. Acest lucru se poate întâmpla în două moduri, în funcție de faptul dacă radicalul ClO lovește o moleculă de ozon sau un radical de oxigen.
dacă lovește un radical de oxigen (produs dintr-una dintre reacțiile pe care le-am analizat anterior):
![]()
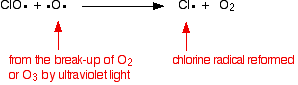
sau dacă lovește o moleculă de ozon:
![]()
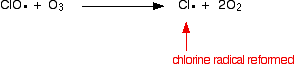
deoarece radicalul de clor continuă să fie regenerat, fiecare poate distruge mii de molecule de ozon.
Autocataliză
oxidarea acidului etandioic prin ioni de manganat(VII)
în autocataliză, reacția este catalizată de unul dintre produsele sale. Unul dintre cele mai simple exemple în acest sens este oxidarea unei soluții de acid etandioic (acid oxalic) printr-o soluție acidificată de manganat de potasiu(VII) (permanganat de potasiu).
![]()
![]()
reacția este foarte lentă la temperatura camerei. Se utilizează ca titrare pentru a găsi concentrația de soluție de manganat de potasiu(VII) și se efectuează de obicei la o temperatură de aproximativ 60 C. C. chiar și așa, este destul de lent pentru a începe.
reacția este catalizată de ionii de mangan(II). Evident, nu există niciunul dintre cei prezenți înainte de începerea reacției și, prin urmare, începe extrem de încet la temperatura camerei. Cu toate acestea, dacă vă uitați la ecuație, veți găsi ioni de mangan(II) printre produse. Se produce din ce în ce mai mult catalizator pe măsură ce reacția se desfășoară și astfel reacția se accelerează.
puteți măsura acest efect prin trasarea concentrației unuia dintre reactanți pe măsură ce trece timpul. Obțineți un grafic destul de diferit de curba normală a ratei pentru o reacție.
cele mai multe reacții dau o curbă de viteză care arată astfel:
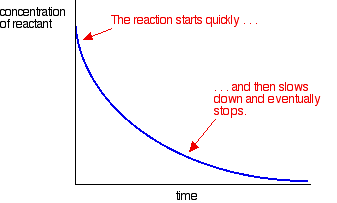
concentrațiile sunt ridicate la început și astfel reacția este rapidă – demonstrată de o scădere rapidă a concentrației reactantului. Pe măsură ce lucrurile se obișnuiesc, reacția încetinește și în cele din urmă se oprește pe măsură ce unul sau mai mulți reactanți sunt complet epuizați.
un exemplu de autocataliză oferă o curbă ca aceasta:
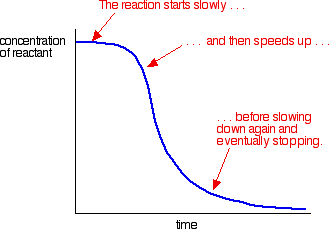
puteți vedea reacția lentă (necatalizată) la început. Pe măsură ce catalizatorul începe să se formeze în amestec, reacția se accelerează – devenind din ce în ce mai rapid pe măsură ce se formează tot mai mult catalizator. În cele din urmă, desigur, rata scade din nou pe măsură ce lucrurile se obișnuiesc.
atenție!
nu presupuneți că o curbă a ratei care arată astfel arată în mod necesar un exemplu de autocataliză. Există și alte efecte care ar putea produce un grafic similar.
de exemplu, dacă reacția a implicat un solid care reacționează cu un lichid, ar putea exista un fel de acoperire de suprafață pe solidul pe care lichidul trebuie să îl pătrundă înainte ca reacția așteptată să se întâmple.
o posibilitate mai frecventă este că aveți o reacție puternic exotermă și nu controlați temperatura în mod corespunzător. Căldura evoluată în timpul reacției accelerează reacția.