Convertitori catalitici
I convertitori catalitici trasformano molecole velenose come il monossido di carbonio e vari ossidi di azoto negli scarichi delle auto in molecole più innocue come l’anidride carbonica e l’azoto. Usano metalli costosi come platino, palladio e rodio come catalizzatore eterogeneo.
I metalli sono depositati come strati sottili su un nido d’ape ceramico. Questo massimizza la superficie e mantiene la quantità di metallo utilizzato al minimo.
Prendendo la reazione tra monossido di carbonio e monossido di azoto come tipico:
![]()
![]()
I convertitori catalitici possono essere influenzati dall’avvelenamento del catalizzatore. Ciò accade quando qualcosa che non fa parte della reazione viene fortemente adsorbito sulla superficie del catalizzatore, impedendo ai normali reagenti di raggiungerlo.
Il piombo è un veleno catalizzatore familiare per i convertitori catalitici. Ricopre il nido d’ape di metalli costosi e smette di funzionare.
In passato, i composti di piombo sono stati aggiunti alla benzina (benzina) per farlo bruciare più agevolmente nel motore. Ma non è possibile utilizzare un convertitore catalitico se si utilizza combustibile al piombo. Quindi i convertitori catalitici non solo hanno contribuito a rimuovere gas velenosi come il monossido di carbonio e gli ossidi di azoto, ma hanno anche forzato la rimozione di composti di piombo velenosi dalla benzina.
Uso dell’ossido di vanadio(V) nel processo di contatto
Durante il processo di contatto per la produzione di acido solforico, l’anidride solforosa deve essere convertita in triossido di zolfo. Questo viene fatto facendo passare anidride solforosa e ossigeno su un catalizzatore di ossido di vanadio solido(V).
![]()
![]()
Questo esempio è leggermente diverso dai precedenti perché i gas reagiscono effettivamente con la superficie del catalizzatore, cambiandolo temporaneamente. È un buon esempio della capacità dei metalli di transizione e dei loro composti di agire come catalizzatori a causa della loro capacità di cambiare il loro stato di ossidazione.
L’anidride solforosa viene ossidata a triossido di zolfo dall’ossido di vanadio(V). Nel processo, l’ossido di vanadio(V) viene ridotto a ossido di vanadio(IV).
![]()
![]()
L’ossido di vanadio(IV) viene quindi ri-ossidato dall’ossigeno.
![]()
![]()
Questo è un buon esempio del modo in cui un catalizzatore può essere cambiato durante il corso di una reazione. Alla fine della reazione, però, sarà chimicamente lo stesso come è iniziato.
Catalisi omogenea
Questo ha il catalizzatore nella stessa fase dei reagenti. In genere tutto sarà presente come gas o contenuto in una singola fase liquida. Gli esempi contengono uno di ciascuno di questi . . .
Esempi di catalisi omogenea
La reazione tra ioni persolfato e ioni ioduro
Questa è una reazione di soluzione che potresti incontrare solo nel contesto della catalisi, ma è un bell’esempio!
Gli ioni persolfati (ioni perossodisolfati), S2O82-, sono agenti ossidanti molto potenti. Gli ioni ioduro sono facilmente ossidati a iodio. Eppure la reazione tra loro in soluzione in acqua è molto lenta.
Se si guarda l’equazione, è facile capire perché:
![]()
![]()
La reazione richiede una collisione tra due ioni negativi. Repulsione sta per ottenere seriamente nel modo di che!
La reazione catalizzata evita completamente questo problema. Il catalizzatore può essere ferro (II) o ferro (III) ioni che vengono aggiunti alla stessa soluzione. Questo è un altro buon esempio dell’uso di composti di metalli di transizione come catalizzatori a causa della loro capacità di cambiare lo stato di ossidazione.
Per ragioni di discussione, prenderemo il catalizzatore come ioni ferro(II). Come vedrai a breve, in realtà non importa se usi ioni di ferro(II) o ferro(III).
Gli ioni persolfato ossidano gli ioni ferro (II) in ioni ferro(III). Nel processo gli ioni persolfato sono ridotti a ioni solfato.
![]()
![]()
Gli ioni di ferro (III) sono agenti ossidanti abbastanza forti da ossidare gli ioni ioduro in iodio. Nel processo, vengono nuovamente ridotti agli ioni di ferro(II).
![]()
![]()
Entrambe queste fasi individuali nella reazione complessiva comportano la collisione tra ioni positivi e negativi. Questo sarà molto più probabile che abbia successo rispetto alla collisione tra due ioni negativi nella reazione non catalizzata.
Cosa succede se si utilizzano ioni ferro (III) come catalizzatore invece di ioni ferro(II)? Le reazioni avvengono semplicemente in un ordine diverso.
La distruzione dell’ozono atmosferico
Questo è un buon esempio di catalisi omogenea dove tutto è presente come un gas.
L’ozono, O3, viene costantemente formato e nuovamente rotto nell’alta atmosfera dall’azione della luce ultravioletta. Le normali molecole di ossigeno assorbono la luce ultravioletta e si rompono in singoli atomi di ossigeno. Questi hanno elettroni spaiati e sono noti come radicali liberi. Sono molto reattivi.
![]()

I radicali dell’ossigeno possono quindi combinarsi con le normali molecole di ossigeno per produrre ozono.
![]()
![]()
L’ozono può anche essere diviso nuovamente in ossigeno ordinario e un radicale dell’ossigeno assorbendo la luce ultravioletta.
![]()
![]()
Questa formazione e la rottura di ozono è in corso per tutto il tempo. Nel loro insieme, queste reazioni fermano molte radiazioni ultraviolette dannose che penetrano nell’atmosfera per raggiungere la superficie della Terra.
La reazione catalitica a cui siamo interessati distrugge l’ozono e quindi lo ferma assorbendo i raggi UV in questo modo.
I clorofluorocarburi (CFC) come CF2Cl2, ad esempio, sono stati ampiamente utilizzati negli aerosol e come refrigeranti. La loro lenta rottura nell’atmosfera produce atomi di cloro-radicali liberi del cloro. Questi catalizzano la distruzione dell’ozono.
Ciò avviene in due fasi. Nel primo, l’ozono viene rotto e viene prodotto un nuovo radicale libero.
![]()
![]()
Il catalizzatore radicale del cloro viene rigenerato da una seconda reazione. Questo può accadere in due modi a seconda che il radicale ClO colpisca una molecola di ozono o un radicale dell’ossigeno.
Se colpisce un radicale dell’ossigeno (prodotto da una delle reazioni che abbiamo esaminato in precedenza):
![]()
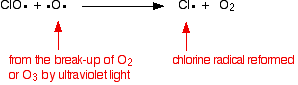
O se colpisce una molecola di ozono:
![]()
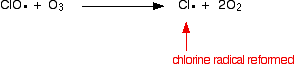
Poiché il radicale del cloro continua ad essere rigenerato, ognuno può distruggere migliaia di molecole di ozono.
Autocatalisi
L’ossidazione dell’acido etandioico da parte degli ioni manganato(VII)
In autocatalisi, la reazione è catalizzata da uno dei suoi prodotti. Uno degli esempi più semplici di questo è nell’ossidazione di una soluzione di acido etandioico (acido ossalico) da una soluzione acidificata di manganato di potassio(VII) (permanganato di potassio).
![]()
![]()
La reazione è molto lenta a temperatura ambiente. È usato come titolazione per trovare la concentrazione di soluzione di manganato di potassio (VII) e di solito viene effettuato ad una temperatura di circa 60°C. Anche così, è piuttosto lento per iniziare.
La reazione è catalizzata da ioni manganese (II). Ovviamente non ci sono nessuno di quelli presenti prima che inizi la reazione, e quindi inizia molto lentamente a temperatura ambiente. Tuttavia, se si guarda l’equazione, troverete ioni manganese(II) tra i prodotti. Sempre più catalizzatore viene prodotto come la reazione procede e così la reazione accelera.
È possibile misurare questo effetto tracciando la concentrazione di uno dei reagenti col passare del tempo. Si ottiene un grafico molto diverso dalla normale curva di velocità per una reazione.
La maggior parte delle reazioni dà una curva di velocità simile a questa:
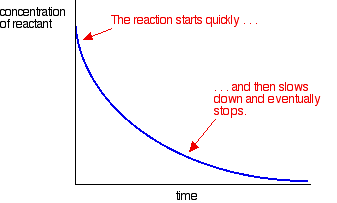
Le concentrazioni sono alte all’inizio e quindi la reazione è veloce-mostrata da una rapida caduta della concentrazione del reagente. Man mano che le cose si esauriscono, la reazione rallenta e alla fine si ferma quando uno o più reagenti sono completamente esauriti.
Un esempio di autocatalisi fornisce una curva come questa:
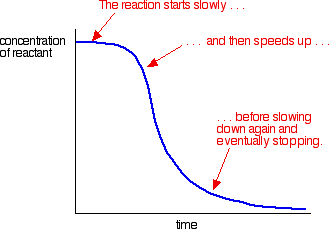
Puoi vedere la reazione lenta (non catalizzata) all’inizio. Quando il catalizzatore inizia a formarsi nella miscela, la reazione accelera, diventando sempre più veloce man mano che si forma sempre più catalizzatore. Alla fine, naturalmente, il tasso scende di nuovo come le cose si esauriscono.
Attenzione!
Non dare per scontato che una curva di velocità simile a questa mostri necessariamente un esempio di autocatalisi. Ci sono altri effetti che potrebbero produrre un grafico simile.
Ad esempio, se la reazione ha coinvolto un solido che reagisce con un liquido, potrebbe esserci una sorta di rivestimento superficiale sul solido che il liquido deve penetrare prima che possa avvenire la reazione prevista.
Una possibilità più comune è che si abbia una reazione fortemente esotermica e non si controlli correttamente la temperatura. Il calore si è evoluto durante la reazione accelera la reazione.