katalysatoren
katalysatoren veranderen giftige moleculen zoals koolmonoxide en verschillende stikstofoxiden in uitlaatgassen van auto ‘ s in meer onschadelijke moleculen zoals kooldioxide en stikstof. Ze gebruiken dure metalen als platina, palladium en rhodium als heterogene katalysator.
de metalen worden als dunne lagen afgezet op een keramische honingraat. Dit maximaliseert het oppervlak en houdt de hoeveelheid metaal die wordt gebruikt tot een minimum.
waarbij de reactie tussen koolmonoxide en stikstofmonoxide als typisch:
![]()
![]()
katalysatoren kunnen worden beïnvloed door katalysatorvergiftiging. Dit gebeurt wanneer iets dat geen deel uitmaakt van de reactie zeer sterk wordt geadsorbeerd aan het oppervlak van de katalysator, waardoor de normale reactanten het niet bereiken.
lood is een bekend katalysatorgif voor katalysatoren. Het bedekt de Honingraat van dure metalen en stopt het werken.
in het verleden werden loodverbindingen toegevoegd aan benzine (benzine) om het soepeler te laten branden in de motor. Maar je kunt geen katalysator gebruiken als je loodhoudende brandstof gebruikt. Dus katalysatoren hebben niet alleen geholpen bij het verwijderen van giftige gassen zoals koolmonoxide en stikstofoxiden, maar hebben ook gedwongen de verwijdering van giftige loodverbindingen uit benzine.
het gebruik van vanadium(V) oxide in het contactproces
tijdens het contactproces voor de vervaardiging van zwavelzuur moet zwaveldioxide worden omgezet in zwaveltrioxide. Dit gebeurt door zwaveldioxide en zuurstof over een vaste vanadium(V) oxide katalysator te laten lopen.
![]()
![]()
dit voorbeeld is iets anders dan de vorige omdat de gassen daadwerkelijk reageren met het oppervlak van de katalysator, waardoor het tijdelijk verandert. Het is een goed voorbeeld van het vermogen van overgangsmetalen en hun samenstellingen om als katalysatoren wegens hun vermogen om hun oxidatietoestand te veranderen op te treden.
het zwaveldioxide wordt door het vanadium(V) oxide tot zwaveltrioxide geoxideerd. In dit proces wordt het Vanadium(V) oxide gereduceerd tot vanadium(IV) oxide.
![]()
![]()
het vanadium (IV) oxide wordt vervolgens opnieuw geoxideerd door de zuurstof.
![]()
![]()
Dit is een goed voorbeeld van de manier waarop een katalysator kan worden veranderd in de loop van een reactie. Aan het einde van de reactie zal het chemisch hetzelfde zijn als het begon.
homogene katalyse
de katalysator bevindt zich in dezelfde fase als de reactanten. Typisch alles zal aanwezig zijn als een gas of opgenomen in een enkele vloeibare fase. De voorbeelden bevatten een van elk van deze . . .
voorbeelden van homogene katalyse
de reactie tussen persulfaationen en jodideionen
dit is een oplossingsreactie die je misschien alleen tegenkomt in de context van katalyse, maar het is een mooi voorbeeld!
Persulfaationen (peroxodisulfaationen), S2O82-, zijn zeer krachtige oxidatiemiddelen. Jodide-ionen worden heel gemakkelijk geoxideerd tot jodium. En toch is de reactie tussen hen in oplossing in water erg traag.
als je naar de vergelijking kijkt, is het gemakkelijk te zien waarom dat is:
![]()
![]()
de reactie heeft een botsing nodig tussen twee negatieve ionen. Walging zal daar serieus in de weg staan!
de gekatalyseerde reactie vermijdt dat probleem volledig. De katalysator kan ijzer(II) of ijzer (III) ionen zijn die aan dezelfde oplossing worden toegevoegd. Dit is een ander goed voorbeeld van het gebruik van overgangsmetaalverbindingen als katalysatoren vanwege hun vermogen om oxidatietoestand te veranderen.
omwille van het argument, nemen we de katalysator als ijzer(II) ionen. Zoals u binnenkort zult zien, maakt het eigenlijk niet uit of u ijzer(II) of ijzer(III) ionen gebruikt.
de persulfaationen oxideren ijzer (II) ionen tot ijzer(III) ionen. Daarbij worden de persulfaationen gereduceerd tot sulfaationen.
![]()
![]()
de ijzer (III) ionen zijn sterk genoeg om jodide-ionen tot jodium te oxideren. Daarbij worden ze weer teruggebracht tot ijzer(II) ionen.
![]()
![]()
beide afzonderlijke stadia in de algemene reactie impliceren botsing tussen positieve en negatieve ionen. Dit zal veel meer kans om succesvol te zijn dan botsing tussen twee negatieve ionen in de niet-gekatalyseerde reactie.
Wat gebeurt er als u ijzer(III) ionen als katalysator gebruikt in plaats van ijzer(II) ionen? De reacties gebeuren gewoon in een andere volgorde.
de vernietiging van atmosferische ozon
dit is een goed voorbeeld van homogene katalyse waarbij alles aanwezig is als gas.
ozon, O3, wordt voortdurend gevormd en weer afgebroken in de hoge atmosfeer door de werking van ultraviolet licht. Gewone zuurstofmoleculen absorberen ultraviolet licht en breken in individuele zuurstofatomen. Deze hebben ongepaarde elektronen en staan bekend als vrije radicalen. Ze zijn zeer reactief.
![]()

de zuurstofradicalen kunnen dan combineren met gewone zuurstofmoleculen om ozon te maken.
![]()
![]()
ozon kan ook weer worden opgesplitst in gewone zuurstof en een zuurstofradicaal door het absorberen van ultraviolet licht.
![]()
![]()
deze vorming en afbraak van ozon is de hele tijd aan de gang. Samen houden deze reacties veel schadelijke ultraviolette straling tegen die de atmosfeer binnendringt om het aardoppervlak te bereiken.
de katalytische reactie waarin wij geïnteresseerd zijn vernietigt ozon en voorkomt zo dat het UV op deze manier absorbeert.
chloorfluorkoolstoffen (CFK ‘ s) zoals bijvoorbeeld CF2Cl2 werden op grote schaal gebruikt in aërosolen en als koelmiddel. Hun langzame afbraak in de atmosfeer produceert chlooratomen-chloor vrije radicalen. Deze katalyseren de vernietiging van de ozon.
dit gebeurt in twee fasen. In de eerste, de ozon wordt afgebroken en een nieuwe vrije radicalen wordt geproduceerd.
![]()
![]()
de chloorradicaalkatalysator wordt geregenereerd door een tweede reactie. Dit kan op twee manieren gebeuren, afhankelijk van of het CLO-radicaal een ozonmolecuul of een zuurstofradicaal raakt.
als het een zuurstofradicaal raakt (geproduceerd door een van de reacties die we eerder hebben bekeken):
![]()
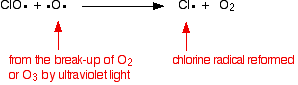
of als het een ozonmolecuul raakt:
![]()
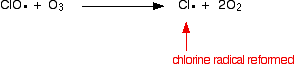
omdat het chloorradicaal blijft regenereren, kan elk daarvan duizenden ozonmoleculen vernietigen.
Autokatalyse
de oxidatie van ethaandizuur door manganaat(VII) – ionen
bij autokatalyse wordt de reactie gekatalyseerd door een van zijn producten. Een van de eenvoudigste voorbeelden hiervan is de oxidatie van een oplossing van ethaandizuur (oxaalzuur) door een aangezuurde oplossing van kalium manganaat(VII) (kaliumpermanganaat).
![]()
![]()
de reactie is erg traag bij kamertemperatuur. Het wordt gebruikt als titratie om de concentratie van kalium manganaat(VII) oplossing te vinden en wordt meestal uitgevoerd bij een temperatuur van ongeveer 60°C. Zelfs zo, het is vrij langzaam om te beginnen met.
de reactie wordt gekatalyseerd door mangaan(II) ionen. Er zijn duidelijk geen van deze aanwezig voordat de reactie begint, en dus begint het extreem langzaam bij kamertemperatuur. Echter, als je kijkt naar de vergelijking, vindt u mangaan(II) ionen onder de producten. Meer en meer katalysator wordt geproduceerd naarmate de reactie vordert en zo versnelt de reactie.
u kunt dit effect meten door de concentratie van een van de reactanten in de loop van de tijd uit te zetten. Je krijgt een grafiek die heel anders is dan de normale snelheidscurve voor een reactie.
de meeste reacties geven een snelheidscurve die er zo uitziet:
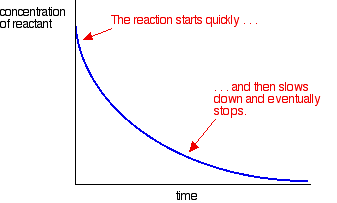
de concentraties zijn hoog aan het begin en zo is de reactie snel – getoond door een snelle daling in de reactantconcentratie. Als dingen uitgeput raken, de reactie vertraagt en uiteindelijk stopt als een of meer van de reactanten zijn volledig opgebruikt.
een voorbeeld van autokatalyse geeft een curve als deze:
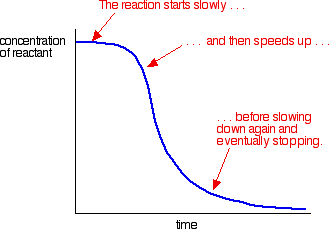
u kunt de langzame (niet-gekatalyseerde) reactie aan het begin zien. Als katalysator begint te worden gevormd in het mengsel, de reactie versnelt – steeds sneller en sneller als meer en meer katalysator wordt gevormd. Uiteindelijk, natuurlijk, het tarief daalt weer als dingen uitgeput raken.
waarschuwing!
ga er niet van uit dat een snelheidscurve die er zo uitziet noodzakelijkerwijs een voorbeeld van autokatalyse toont. Er zijn andere effecten die een soortgelijke grafiek kunnen produceren.
als de reactie bijvoorbeeld een vaste stof met een vloeistof betreft, kan er een soort oppervlaktecoating op de vaste stof aanwezig zijn die de vloeistof moet binnendringen voordat de verwachte reactie kan plaatsvinden.
een veel voorkomende mogelijkheid is dat u een sterk exotherme reactie hebt en de temperatuur niet goed regelt. De warmte evolueerde tijdens de reactie versnelt de reactie.