katalizatory
katalizatory zmieniają trujące cząsteczki, takie jak tlenek węgla i różne tlenki azotu w spalinach samochodowych w bardziej nieszkodliwe cząsteczki, takie jak dwutlenek węgla i azot. Wykorzystują drogie metale, takie jak platyna, pallad i Rod jako heterogeniczny katalizator.
metale są nanoszone jako cienkie warstwy na ceramiczny plaster miodu. To maksymalizuje powierzchnię i ogranicza ilość metalu użytego do minimum.
typowa reakcja tlenku węgla i tlenku azotu:
![]()
![]()
katalizatory mogą być dotknięte zatruciem katalizatorem. Dzieje się tak, gdy coś, co nie jest częścią reakcji, zostaje bardzo silnie zaadsorbowane na powierzchni katalizatora, zapobiegając dotarciu do niego normalnych reagentów.
ołów jest znanym katalizatorem dla katalizatorów. Pokrywa plaster miodu drogich metali i przestaje działać.
w przeszłości do benzyny (benzyny) dodawano związki ołowiu, aby bardziej płynnie paliła się w silniku. Ale nie możesz użyć katalizatora, jeśli używasz paliwa ołowiowego. Tak więc katalizatory nie tylko pomogły usunąć trujące gazy, takie jak tlenek węgla i tlenki azotu, ale także wymusiły usunięcie trujących związków ołowiu z benzyny.
zastosowanie tlenku wanadu (V) w procesie kontaktowym
podczas procesu kontaktowego do produkcji kwasu siarkowego dwutlenek siarki musi zostać przekształcony w trójtlenek siarki. Odbywa się to poprzez przepuszczanie dwutlenku siarki i tlenu przez stały katalizator tlenku wanadu(V).
![]()
![]()
ten przykład różni się nieco od poprzednich, ponieważ gazy faktycznie reagują z powierzchnią katalizatora, tymczasowo go zmieniając. Jest to dobry przykład zdolności metali przejściowych i ich związków do działania jako katalizatory ze względu na ich zdolność do zmiany stanu utleniania.
dwutlenek siarki utlenia się do trójtlenku siarki przez tlenek wanadu(V). W procesie tym tlenek wanadu(V) redukuje się do tlenku wanadu(IV).
![]()
![]()
tlenek wanadu(IV) jest następnie ponownie utleniany przez tlen.
![]()
![]()
jest to dobry przykład sposobu, w jaki katalizator może być zmieniony w trakcie reakcji. Pod koniec reakcji będzie jednak chemicznie taka sama, jak się zaczęła.
kataliza homogeniczna
katalizator ten ma tę samą fazę co reagenty. Typowo wszystko będzie obecne jako gaz lub zawarte w pojedynczej fazie ciekłej. Przykłady zawierają po jednym z nich . . .
przykłady katalizy homogenicznej
reakcja między jonami nadsiarczanu i jonami jodku
jest to reakcja roztworu, którą można spotkać tylko w kontekście katalizy, ale jest to piękny przykład!
jony Nadsiarczanowe (jony nadsiarczanowe), S2O82-, są bardzo silnymi środkami utleniającymi. Jony jodkowe bardzo łatwo ulegają utlenieniu do jodu. A jednak reakcja między nimi w roztworze w wodzie jest bardzo powolna.
jeśli spojrzysz na równanie, łatwo zrozumieć, dlaczego tak jest:
![]()
![]()
reakcja wymaga zderzenia dwóch jonów ujemnych. Wstręt poważnie temu przeszkodzi!
katalizowana reakcja całkowicie unika tego problemu. Katalizatorem mogą być jony żelaza (II) lub żelaza(III), które są dodawane do tego samego roztworu. Jest to kolejny dobry przykład zastosowania związków metali przejściowych jako katalizatorów ze względu na ich zdolność do zmiany stanu utleniania.
dla dobra argumentacji bierzemy katalizator za jony żelaza(II). Jak wkrótce zobaczysz, nie ma znaczenia, czy używasz jonów żelaza(II), czy żelaza(III).
jony nadsiarczanu utleniają jony żelaza(II) do jonów żelaza(III). W procesie tym jony nadsiarczanowe są redukowane do jonów siarczanowych.
![]()
![]()
jony żelaza (III) są wystarczająco silnymi środkami utleniającymi, aby utlenić jony jodkowe do jodu. W procesie tym są one ponownie redukowane do jonów żelaza (II).
![]()
![]()
oba te poszczególne etapy w ogólnej reakcji obejmują zderzenie między dodatnimi i ujemnymi jonami. Będzie to o wiele bardziej prawdopodobne niż zderzenie dwóch ujemnych jonów w reakcji nieskatalizowanej.
co się stanie, jeśli użyjesz jonów żelaza(III) jako katalizatora zamiast jonów żelaza(II)? Reakcje następują po prostu w innej kolejności.
niszczenie ozonu atmosferycznego
jest to dobry przykład jednorodnej katalizy, w której wszystko jest obecne jako gaz.
Ozon, O3, jest stale formowany i ponownie rozkładany w wysokiej atmosferze przez działanie światła ultrafioletowego. Zwykłe cząsteczki tlenu absorbują światło ultrafioletowe i rozpadają się na pojedyncze atomy tlenu. Mają niesparowane elektrony i są znane jako wolne rodniki. Są bardzo reaktywne.
![]()

rodniki tlenowe mogą następnie łączyć się ze zwykłymi cząsteczkami tlenu, tworząc Ozon.
![]()
![]()
Ozon można również ponownie podzielić na zwykły tlen i rodnik tlenowy poprzez pochłanianie światła ultrafioletowego.
![]()
![]()
to powstawanie i rozpad ozonu trwa cały czas. Łącznie reakcje te zatrzymują wiele szkodliwego promieniowania ultrafioletowego przenikającego do atmosfery, aby dotrzeć do powierzchni Ziemi.
reakcja katalityczna, którą jesteśmy zainteresowani, niszczy ozon i w ten sposób zatrzymuje wchłanianie UV.
Chlorofluorowęglowodory (CFC), takie jak na przykład CF2Cl2, były szeroko stosowane w aerozolach i jako czynniki chłodnicze. Ich powolny rozpad w atmosferze powoduje powstanie atomów chloru-wolnych rodników chloru. Katalizują one niszczenie ozonu.
dzieje się to w dwóch etapach. W pierwszym Ozon ulega rozpadowi i powstaje nowy wolny rodnik.
![]()
![]()
katalizator rodników chloru jest regenerowany w drugiej reakcji. Może się to zdarzyć na dwa sposoby, w zależności od tego, czy Rodnik ClO uderza w cząsteczkę ozonu, czy w Rodnik tlenu.
jeśli uderzy w Rodnik tlenowy (powstały w wyniku jednej z reakcji, na które wcześniej patrzyliśmy):
![]()
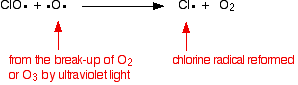
lub jeśli uderzy w cząsteczkę ozonu:
![]()
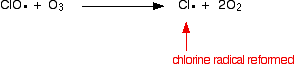
ponieważ Rodnik chloru wciąż się regeneruje, każdy z nich może zniszczyć tysiące cząsteczek ozonu.
Autokataliza
utlenianie kwasu etanodiowego jonami manganianu(VII)
w autokatalizie reakcja jest katalizowana przez jeden z jej produktów. Jednym z najprostszych przykładów jest utlenianie roztworu kwasu etanodiowego (kwasu szczawiowego) przez zakwaszony roztwór manganianu potasu(VII) (nadmanganianu potasu).
![]()
![]()
reakcja przebiega bardzo wolno w temperaturze pokojowej. Jest on stosowany jako miareczkowanie w celu znalezienia stężenia roztworu manganianu potasu (VII) i zwykle przeprowadza się go w temperaturze około 60°C. Mimo to jest dość powolny.
reakcja jest katalizowana przez jony manganu (II). Oczywiście nie ma żadnego z nich przed rozpoczęciem reakcji, więc zaczyna się bardzo powoli w temperaturze pokojowej. Jeśli jednak przyjrzymy się równaniu, wśród produktów znajdziemy jony manganu (II). Coraz więcej katalizatora jest wytwarzany w miarę przebiegu reakcji, a więc reakcja przyspiesza.
możesz zmierzyć ten efekt, rysując stężenie jednego z reagentów w miarę upływu czasu. Otrzymujemy Wykres zupełnie niepodobny do normalnej krzywej szybkości reakcji.
większość reakcji daje krzywą szybkości, która wygląda tak:
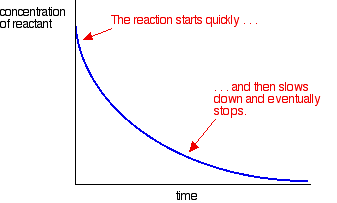
stężenia są wysokie na początku, a więc reakcja jest szybka-przejawia się gwałtownym spadkiem stężenia reagenta. Jak rzeczy się zużywają, reakcja spowalnia i ostatecznie zatrzymuje się, jak jeden lub więcej reagentów są całkowicie zużyte.
przykład autokatalizy daje krzywą taką jak ta:
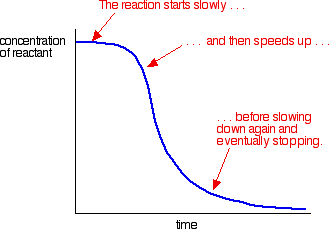
możesz zobaczyć powolną (nieskatalizowaną) reakcję na początku. Gdy katalizator zaczyna być formowany w mieszaninie, reakcja przyspiesza – coraz szybciej, gdy powstaje coraz więcej katalizatora. W końcu, oczywiście, stopa spada ponownie jak rzeczy się zużywają.
Uwaga!
nie zakładaj, że krzywa stawki, która wygląda tak, koniecznie pokazuje przykład autokatalizy. Istnieją inne efekty, które mogą spowodować podobny Wykres.
na przykład, jeśli reakcja dotyczy ciała stałego reagującego z cieczą, może istnieć pewien rodzaj powłoki powierzchniowej na ciele stałym, którą ciecz musi przeniknąć, zanim spodziewana reakcja może się zdarzyć.
bardziej powszechną możliwością jest to, że masz silnie egzotermiczną reakcję i nie kontrolujesz właściwie temperatury. Ciepło wyewoluowane podczas reakcji przyspiesza reakcję.