katalysatorer
katalysatorer förändrar giftiga molekyler som kolmonoxid och olika kväveoxider i bilavgaser till mer ofarliga molekyler som koldioxid och kväve. De använder dyra metaller som platina, palladium och rodium som heterogen katalysator.
metallerna deponeras som tunna skikt på en keramisk honungskaka. Detta maximerar ytan och håller mängden metall som används till ett minimum.
tar reaktionen mellan kolmonoxid och kvävemonoxid som typisk:
![]()
![]()
katalysatorer kan påverkas av katalysatorförgiftning. Detta händer när något som inte är en del av reaktionen blir mycket starkt adsorberat på katalysatorns yta, vilket förhindrar att de normala reaktanterna når den.
bly är ett välkänt katalysatorgift för katalysatorer. Det täcker bikakan av dyra metaller och slutar att fungera.
tidigare tillsattes blyföreningar till bensin (bensin) för att få det att brinna smidigare i motorn. Men du kan inte använda en katalysator om du använder blybränsle. Så katalysatorer har inte bara hjälpt till att avlägsna giftiga gaser som kolmonoxid och kväveoxider, men har också tvingat bort giftiga blyföreningar från bensin.
användning av vanadin(V) oxid i kontaktprocessen
under kontaktprocessen för tillverkning av svavelsyra måste svaveldioxid omvandlas till svaveltrioxid. Detta görs genom att passera svaveldioxid och syre över en fast vanadin(V) oxidkatalysator.
![]()
![]()
detta exempel skiljer sig något från de tidigare eftersom gaserna faktiskt reagerar med katalysatorns yta och tillfälligt ändrar den. Det är ett bra exempel på förmågan hos övergångsmetaller och deras föreningar att fungera som katalysatorer på grund av deras förmåga att ändra deras oxidationstillstånd.
svaveldioxiden oxideras till svaveltrioxid av vanadin (V) oxid. I processen reduceras vanadin(V) oxid till vanadin(IV) oxid.
![]()
![]()
vanadin (IV) oxideras sedan av syret.
![]()
![]()
detta är ett bra exempel på hur en katalysator kan ändras under en reaktion. I slutet av reaktionen kommer det dock att vara kemiskt detsamma som det började.
homogen katalys
detta har katalysatorn i samma fas som reaktanterna. Vanligtvis kommer allt att vara närvarande som en gas eller innehålla en enda vätskefas. Exemplen innehåller en av var och en av dessa . . .
exempel på homogen katalys
reaktionen mellan persulfatjoner och jodidjoner
detta är en lösningsreaktion som du kanske bara möter i samband med katalys, men det är ett härligt exempel!
Persulfatjoner (peroxodisulfatjoner), S2O82-, är mycket kraftfulla oxidationsmedel. Jodidjoner oxideras mycket lätt till jod. Och ändå är reaktionen mellan dem i lösning i vatten mycket långsam.
om du tittar på ekvationen är det lätt att se varför det är:
![]()
![]()
reaktionen behöver en kollision mellan två negativa joner. Repulsion kommer att bli allvarligt i vägen för det!
den katalyserade reaktionen undviker det problemet helt. Katalysatorn kan vara antingen järn(II) eller järn (III) joner som tillsätts till samma lösning. Detta är ett annat bra exempel på användningen av övergångsmetallföreningar som katalysatorer på grund av deras förmåga att ändra oxidationstillstånd.
för argumentets skull tar vi katalysatorn för att vara järn (II) joner. Som du kommer att se inom kort spelar det ingen roll om du använder järn(II) eller järn (III) joner.
persulfatjonerna oxiderar järn(II) joner till järn (III) joner. I processen reduceras persulfatjonerna till sulfatjoner.
![]()
![]()
järnjonerna (III) är tillräckligt starka oxidationsmedel för att oxidera jodidjoner till jod. I processen reduceras de tillbaka till järn(II) joner igen.
![]()
![]()
båda dessa individuella steg i den totala reaktionen involverar kollision mellan positiva och negativa joner. Detta kommer att vara mycket mer sannolikt att lyckas än kollision mellan två negativa joner i den okatalyserade reaktionen.
vad händer om du använder järn(III) joner som katalysator istället för järn(II) joner? Reaktionerna sker helt enkelt i en annan ordning.
förstörelsen av atmosfäriskt Ozon
Detta är ett bra exempel på homogen katalys där allt är närvarande som en gas.
Ozon, O3, bildas ständigt och bryts upp igen i den höga atmosfären genom ultraviolett ljus. Vanliga syremolekyler absorberar ultraviolett ljus och bryter in i enskilda syreatomer. Dessa har oparade elektroner och är kända som fria radikaler. De är mycket reaktiva.
![]()

syreradikalerna kan sedan kombineras med vanliga syremolekyler för att göra Ozon.
![]()
![]()
ozon kan också delas upp igen i vanligt syre och en syreradikal genom att absorbera ultraviolett ljus.
![]()
![]()
denna bildning och nedbrytning av ozon pågår hela tiden. Sammantaget stoppar dessa reaktioner mycket skadlig ultraviolett strålning som tränger in i atmosfären för att nå jordens yta.
den katalytiska reaktionen vi är intresserade av förstör ozonet och stoppar därför att det absorberar UV på detta sätt.
klorfluorkolväten (CFC) som CF2Cl2, till exempel, användes i stor utsträckning i aerosoler och som köldmedier. Deras långsamma nedbrytning i atmosfären ger kloratomer-klorfria radikaler. Dessa katalyserar förstörelsen av ozonet.
detta händer i två steg. I det första bryts ozonet upp och en ny fri radikal produceras.
![]()
![]()
klorradikalkatalysatorn regenereras genom en andra reaktion. Detta kan hända på två sätt beroende på om ClO-radikalen träffar en ozonmolekyl eller en syreradikal.
om det träffar en syreradikal (producerad från en av de reaktioner vi har tittat på tidigare):
![]()
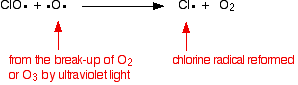
eller om den träffar en ozonmolekyl:
![]()
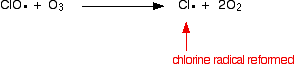
eftersom klorradikalen fortsätter att regenereras kan var och en förstöra tusentals ozonmolekyler.
Autokatalys
oxidationen av etandisyra med manganat(VII) joner
i autokatalys katalyseras reaktionen av en av dess produkter. Ett av de enklaste exemplen på detta är oxidationen av en lösning av etandisyra (oxalsyra) med en surgjord lösning av kaliummanganat(VII) (kaliumpermanganat).
![]()
![]()
reaktionen är mycket långsam vid rumstemperatur. Det används som en titrering för att hitta koncentrationen av kaliummanganat(VII) – lösning och utförs vanligtvis vid en temperatur av ca 60 kcal C. ändå är det ganska långsamt att börja med.
reaktionen katalyseras av mangan(II) joner. Det finns uppenbarligen inte någon av de närvarande innan reaktionen börjar, och så börjar den extremt långsamt vid rumstemperatur. Men om du tittar på ekvationen hittar du mangan(II) joner bland produkterna. Mer och mer katalysator produceras som reaktionen fortskrider och så reaktionen snabbar upp.
du kan mäta denna effekt genom att plotta koncentrationen av en av reaktanterna när tiden går. Du får en graf ganska olik den normala kurvan för en reaktion.
de flesta reaktioner ger en kurva som ser ut så här:
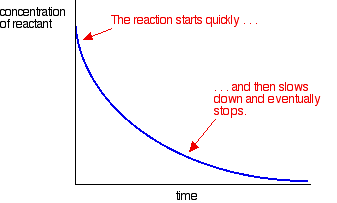
koncentrationerna är höga i början och så är reaktionen snabb – visad av ett snabbt fall i reaktantkoncentrationen. När saker och ting blir förbrukade, saktar reaktionen ner och slutar så småningom när en eller flera av reaktanterna är helt förbrukade.
ett exempel på autokatalys ger en kurva så här:
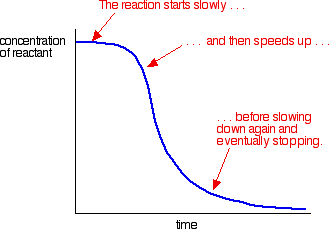
du kan se den långsamma (okatalyserade) reaktionen i början. När katalysatorn börjar bildas i blandningen snabbar reaktionen upp – blir snabbare och snabbare när mer och mer katalysator bildas. Så småningom faller kursen igen när saker blir vana.
Varning!
Antag inte att en kurva som ser ut så här nödvändigtvis visar ett exempel på autokatalys. Det finns andra effekter som kan ge en liknande graf.
till exempel, om reaktionen involverade ett fast ämne som reagerar med en vätska, kan det finnas någon form av ytbeläggning på det fasta ämnet som vätskan måste penetrera innan den förväntade reaktionen kan hända.
en vanligare möjlighet är att du har en starkt exoterm reaktion och inte kontrollerar temperaturen ordentligt. Värmen som utvecklats under reaktionen påskyndar reaktionen.