Katalysatoren
Katalysatoren wandeln giftige Moleküle wie Kohlenmonoxid und verschiedene Stickoxide in Autoabgasen in harmlosere Moleküle wie Kohlendioxid und Stickstoff um. Sie verwenden teure Metalle wie Platin, Palladium und Rhodium als heterogenen Katalysator.
Die Metalle werden als dünne Schichten auf einer keramischen Wabe abgeschieden. Dies maximiert die Oberfläche und hält die Menge des verwendeten Metalls auf ein Minimum.
Wobei die Reaktion zwischen Kohlenmonoxid und Stickstoffmonoxid als typische:
![]()
![]()
Katalysatoren können von Katalysatorvergiftungen betroffen sein. Dies geschieht, wenn etwas, das nicht Teil der Reaktion ist, sehr stark an der Oberfläche des Katalysators adsorbiert wird und verhindert, dass die normalen Reaktanten es erreichen.
Blei ist ein bekanntes Katalysatorgift für Katalysatoren. Es beschichtet die Wabe von teuren Metallen und stoppt sie arbeiten.
In der Vergangenheit wurden Benzin (Benzin) Bleiverbindungen zugesetzt, damit es im Motor reibungsloser brennt. Sie können jedoch keinen Katalysator verwenden, wenn Sie verbleites Benzin verwenden. So haben Katalysatoren nicht nur dazu beigetragen, giftige Gase wie Kohlenmonoxid und Stickoxide zu entfernen, sondern auch die Entfernung giftiger Bleiverbindungen aus Benzin erzwungen.
Verwendung von Vanadium(V) oxid im Kontaktverfahren
Beim Kontaktverfahren zur Herstellung von Schwefelsäure muss Schwefeldioxid in Schwefeltrioxid umgewandelt werden. Dies geschieht, indem Schwefeldioxid und Sauerstoff über einen festen Vanadium (V) -oxidkatalysator geleitet werden.
![]()
![]()
Dieses Beispiel unterscheidet sich geringfügig von den vorherigen, da die Gase tatsächlich mit der Oberfläche des Katalysators reagieren und diese vorübergehend verändern. Es ist ein gutes Beispiel für die Fähigkeit von Übergangsmetallen und ihren Verbindungen, aufgrund ihrer Fähigkeit, ihren Oxidationszustand zu ändern, als Katalysatoren zu wirken.
Das Schwefeldioxid wird durch das Vanadium(V) oxid zu Schwefeltrioxid oxidiert. Dabei wird das Vanadium(V) oxid zu Vanadium(IV) oxid reduziert.
![]()
![]()
Das Vanadium(IV) oxid wird dann durch den Sauerstoff reoxidiert.
![]()
![]()
Dies ist ein gutes Beispiel dafür, wie ein Katalysator im Verlauf einer Reaktion verändert werden kann. Am Ende der Reaktion wird es jedoch chemisch dasselbe sein, wie es begonnen hat.
Homogene Katalyse
Hierbei befindet sich der Katalysator in der gleichen Phase wie die Reaktanten. Typischerweise liegt alles als Gas vor oder ist in einer einzigen flüssigen Phase enthalten. Die Beispiele enthalten jeweils eines davon . . .
Beispiele für homogene Katalyse
Die Reaktion zwischen Persulfationen und Iodidionen
Dies ist eine Lösungsreaktion, die Sie möglicherweise nur im Zusammenhang mit der Katalyse treffen, aber es ist ein schönes Beispiel!
Persulfat-Ionen (Peroxodisulfat-Ionen), S2O82-, sind sehr starke Oxidationsmittel. Jodidionen werden sehr leicht zu Jod oxidiert. Und doch ist die Reaktion zwischen ihnen in Lösung in Wasser sehr langsam.
Wenn Sie sich die Gleichung ansehen, ist es leicht zu verstehen, warum das so ist:
![]()
![]()
Die Reaktion benötigt eine Kollision zwischen zwei negativen Ionen. Abstoßung wird ernsthaft in die Quere kommen!
Die katalysierte Reaktion vermeidet dieses Problem vollständig. Der Katalysator kann entweder Eisen(II)- oder Eisen(III)-Ionen sein, die derselben Lösung zugesetzt werden. Dies ist ein weiteres gutes Beispiel für die Verwendung von Übergangsmetallverbindungen als Katalysatoren aufgrund ihrer Fähigkeit, die Oxidationsstufe zu ändern.
Der Argumentation halber nehmen wir an, dass der Katalysator Eisen (II) -Ionen sind. Wie Sie in Kürze sehen werden, spielt es keine Rolle, ob Sie Eisen (II) – oder Eisen (III) -Ionen verwenden.
Die Persulfationen oxidieren die Eisen(II)-Ionen zu Eisen(III)-Ionen. Dabei werden die Persulfationen zu Sulfationen reduziert.
![]()
![]()
Die Eisen(III)-Ionen sind stark genug, um Jodidionen zu Jod zu oxidieren. Dabei werden sie wieder zu Eisen(II)-Ionen reduziert.
![]()
![]()
Bei beiden Einzelstufen der Gesamtreaktion kommt es zur Kollision von positiven und negativen Ionen. Dies wird viel wahrscheinlicher erfolgreich sein als die Kollision zwischen zwei negativen Ionen in der unkatalysierten Reaktion.
Was passiert, wenn Sie Eisen (III) -Ionen anstelle von Eisen(II) -Ionen als Katalysator verwenden? Die Reaktionen laufen einfach in einer anderen Reihenfolge ab.
Die Zerstörung des atmosphärischen Ozons
Dies ist ein gutes Beispiel für eine homogene Katalyse, bei der alles als Gas vorliegt.
Ozon, O3, wird in der hohen Atmosphäre durch Einwirkung von ultraviolettem Licht ständig gebildet und wieder abgebaut. Gewöhnliche Sauerstoffmoleküle absorbieren ultraviolettes Licht und brechen in einzelne Sauerstoffatome auf. Diese haben ungepaarte Elektronen und werden als freie Radikale bezeichnet. Sie sind sehr reaktiv.
![]()

Die Sauerstoffradikale können sich dann mit gewöhnlichen Sauerstoffmolekülen zu Ozon verbinden.
![]()
![]()
Ozon kann auch durch Absorption von ultraviolettem Licht wieder in gewöhnlichen Sauerstoff und ein Sauerstoffradikal aufgespalten werden.
![]()
![]()
Diese Bildung und Zersetzung von Ozon findet ständig statt. Zusammengenommen verhindern diese Reaktionen, dass viel schädliche ultraviolette Strahlung in die Atmosphäre eindringt, um die Erdoberfläche zu erreichen.
Die katalytische Reaktion, an der wir interessiert sind, zerstört das Ozon und verhindert so, dass es auf diese Weise UV absorbiert.
Fluorchlorkohlenwasserstoffe (FCKW) wie beispielsweise CF2Cl2 wurden in großem Umfang in Aerosolen und als Kältemittel verwendet. Ihr langsamer Abbau in der Atmosphäre erzeugt Chloratome – freie Chlorradikale. Diese katalysieren die Zerstörung des Ozons.
Dies geschieht in zwei Stufen. In der ersten wird das Ozon abgebaut und ein neues freies Radikal erzeugt.
![]()
![]()
Der Chlorradikal-Katalysator wird durch eine zweite Reaktion regeneriert. Dies kann auf zwei Arten geschehen, je nachdem, ob das CLO-Radikal auf ein Ozonmolekül oder ein Sauerstoffradikal trifft.
Wenn es auf ein Sauerstoffradikal trifft (erzeugt aus einer der Reaktionen, die wir zuvor untersucht haben):
![]()
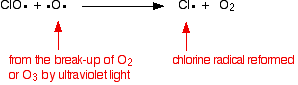
Oder wenn es auf ein Ozonmolekül trifft:
![]()
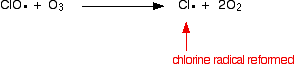
Da das Chlorradikal immer wieder regeneriert wird, kann jedes einzelne Tausende von Ozonmolekülen zerstören.
Autokatalyse
Die Oxidation von Ethandisäure durch Manganat(VII) -ionen
Bei der Autokatalyse wird die Reaktion durch eines ihrer Produkte katalysiert. Eines der einfachsten Beispiele hierfür ist die Oxidation einer Lösung von Ethandisäure (Oxalsäure) durch eine angesäuerte Lösung von Kaliummanganat (VII) (Kaliumpermanganat).
![]()
![]()
Die Reaktion verläuft bei Raumtemperatur sehr langsam. Es wird als Titration verwendet, um die Konzentration von Kaliummanganat (VII) -lösung zu finden, und wird normalerweise bei einer Temperatur von etwa 60 ° C durchgeführt.
Die Reaktion wird durch Mangan(II)-ionen katalysiert. Es gibt offensichtlich keine von denen, die vorhanden sind, bevor die Reaktion beginnt, und so beginnt es extrem langsam bei Raumtemperatur. Wenn Sie sich jedoch die Gleichung ansehen, finden Sie Mangan (II) -Ionen unter den Produkten. Mit fortschreitender Reaktion wird immer mehr Katalysator produziert, wodurch sich die Reaktion beschleunigt.
Sie können diesen Effekt messen, indem Sie die Konzentration eines der Reaktanten im Laufe der Zeit darstellen. Sie erhalten ein Diagramm ganz anders als die normale Geschwindigkeitskurve für eine Reaktion.
Die meisten Reaktionen ergeben eine Ratenkurve, die wie folgt aussieht:
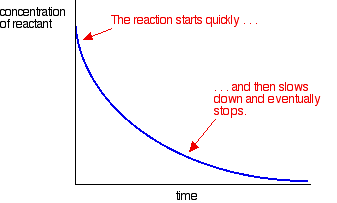
Die Konzentrationen sind zu Beginn hoch und so ist die Reaktion schnell – was sich in einem schnellen Abfall der Reaktionsmittelkonzentration zeigt. Wenn die Dinge aufgebraucht sind, verlangsamt sich die Reaktion und stoppt schließlich, wenn einer oder mehrere der Reaktanten vollständig aufgebraucht sind.
Ein Beispiel für die Autokatalyse ergibt eine Kurve wie diese:
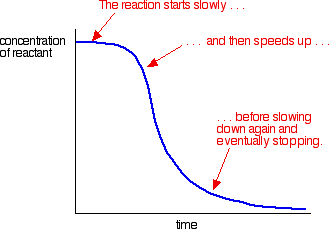
Sie können die langsame (unkatalysierte) Reaktion zu Beginn sehen. Als Katalysator beginnt in der Mischung gebildet werden, die Reaktion beschleunigt – immer schneller und schneller als mehr und mehr Katalysator gebildet wird. Schließlich fällt die Rate natürlich wieder, wenn die Dinge aufgebraucht sind.
Warnung!
Gehen Sie nicht davon aus, dass eine Ratenkurve, die so aussieht, notwendigerweise ein Beispiel für eine Autokatalyse darstellt. Es gibt andere Effekte, die ein ähnliches Diagramm erzeugen könnten.
Wenn zum Beispiel ein Feststoff mit einer Flüssigkeit reagiert, kann es eine Art Oberflächenbeschichtung auf dem Feststoff geben, die die Flüssigkeit durchdringen muss, bevor die erwartete Reaktion stattfinden kann.
Eine häufigere Möglichkeit ist, dass Sie eine stark exotherme Reaktion haben und die Temperatur nicht richtig kontrollieren. Die während der Reaktion entstehende Wärme beschleunigt die Reaktion.