Katalysaattorit
Katalysaattorit muuttavat myrkyllisiä molekyylejä kuten hiilimonoksidia ja erilaisia typen oksideja autojen pakoputkissa vaarattomammiksi molekyyleiksi, kuten hiilidioksidiksi ja typeksi. Heterogeenisenä katalyyttinä käytetään kalliita metalleja, kuten platinaa, palladiumia ja rodiumia.
metallit kerrostuvat ohuina kerroksina keraamisen hunajakennon päälle. Tämä maksimoi pinta-alan ja pitää käytetyn metallin määrän mahdollisimman pienenä.
kun hiilimonoksidin ja typpimonoksidin välinen reaktio on tyypillinen:
![]()
![]()
katalysaattoreihin voi vaikuttaa katalyyttimyrkytys. Tämä tapahtuu, kun jokin, joka ei ole osa reaktiota, adsorboituu hyvin voimakkaasti katalyytin pinnalle estäen normaaleja reaktantteja pääsemästä siihen.
lyijy on tuttu katalyyttimyrkky katalysaattoreille. Se peittää kalliiden metallien hunajakennon ja estää sen toiminnan.
aiemmin bensiiniin lisättiin lyijyyhdisteitä, jotta se palaisi pehmeämmin moottorissa. Mutta et voi käyttää katalysaattoria, jos käytät lyijypitoista polttoainetta. Katalysaattorit eivät siis ole ainoastaan auttaneet poistamaan myrkyllisiä kaasuja, kuten hiilimonoksidia ja typen oksideja, vaan ne ovat myös pakottaneet poistamaan myrkyllisiä lyijy-yhdisteitä bensiinistä.
vanadiini(V) oksidin käyttö Kontaktiprosessissa
Kontaktiprosessissa rikkihapon valmistuksessa rikkidioksidi on muunnettava rikkitrioksidiksi. Tämä tapahtuu johtamalla rikkidioksidia ja happea vanadiini(V) oksidikatalyytin päälle.
![]()
![]()
tämä esimerkki poikkeaa hieman edellisistä, koska kaasut todella reagoivat katalyytin pinnan kanssa muuttaen sitä väliaikaisesti. Se on hyvä esimerkki siirtymämetallien ja niiden yhdisteiden kyvystä toimia katalyytteinä, koska ne kykenevät muuttamaan hapetustilaansa.
rikkidioksidi hapetetaan rikkitrioksidiksi vanadiini(V) oksidin avulla. Prosessissa vanadiini (V) oksidi pelkistyy vanadiini(IV) oksidiksi.
![]()
![]()
tämän jälkeen vanadiini (IV) oksidi hapettuu uudelleen hapen vaikutuksesta.
![]()
![]()
tämä on hyvä esimerkki siitä, miten katalyyttiä voidaan muuttaa reaktion aikana. Reaktion lopussa se on kuitenkin kemiallisesti sama kuin alkanutkin.
homogeeninen katalyysi
tässä katalyytti on samassa faasissa reaktanttien kanssa. Tyypillisesti kaikki on läsnä kaasuna tai sisältyy yhdessä nestefaasissa. Esimerkit sisältävät yhden näistä . . .
esimerkkejä homogeenisesta katalyysistä
persulfaatti-ionien ja jodidi-ionien välinen reaktio
tämä on liuosreaktio, jonka voi hyvinkin tavata vain katalyysin yhteydessä, mutta se on ihana esimerkki!
Persulfaatti-ionit (peroksodisulfaatti-ionit), S2O82 -, ovat erittäin voimakkaita hapettavia aineita. Jodidi-ionit hapettuvat hyvin helposti jodiksi. Silti niiden välinen reaktio liuoksessa vedessä on hyvin hidas.
jos tarkastellaan yhtälöä, on helppo ymmärtää, miksi se on:
![]()
![]()
reaktio vaatii kahden negatiivisen ionin törmäyksen. Vastenmielisyys tulee olemaan sen tiellä!
katalysoitu reaktio välttää tämän ongelman kokonaan. Katalyyttinä voi olla joko rauta(II) tai rauta(III) ioneja, jotka lisätään samaan liuokseen. Tämä on toinen hyvä esimerkki siirtymämetalliyhdisteiden käytöstä katalyytteinä, koska ne kykenevät muuttamaan hapetustilaansa.
argumentoinnin vuoksi otamme katalyytin rauta (II) ioneiksi. Kuten näette pian, sillä ei ole väliä, käytätkö rauta(II) tai rauta(III) ioneja.
persulfaatti-ionit hapettavat rauta (II) – ionit rauta(III) – ioneiksi. Prosessissa persulfaatti-ionit pelkistyvät sulfaatti-ioneiksi.
![]()
![]()
rauta (III) – ionit ovat riittävän vahvoja hapettavia aineita hapettaakseen jodidi-ionit jodiksi. Prosessissa ne pelkistyvät jälleen rauta (II) ioneiksi.
![]()
![]()
molemmissa yksittäisissä vaiheissa kokonaisreaktiossa tapahtuu positiivisten ja negatiivisten ionien yhteentörmäys. Tämä onnistuu paljon todennäköisemmin kuin kahden negatiivisen ionin törmäys katalysoimattomassa reaktiossa.
mitä tapahtuu, jos katalyyttinä käytetään rauta(III) ioneja rauta(II) ionien sijaan? Reaktiot yksinkertaisesti tapahtuvat eri järjestyksessä.
ilmakehän otsonin tuhoutuminen
tämä on hyvä esimerkki homogeenisesta katalyysistä, jossa kaikki on läsnä kaasuna.
otsonia, O3, muodostuu jatkuvasti ja hajoaa uudelleen korkeassa ilmakehässä ultraviolettivalon vaikutuksesta. Tavalliset happimolekyylit absorboivat ultraviolettivaloa ja hajoavat yksittäisiksi happiatomeiksi. Näillä on parittomia elektroneja, ja niitä kutsutaan vapaiksi radikaaleiksi. Ne ovat hyvin reaktiivisia.
![]()

happiradikaalit voivat sitten yhdistyä tavallisten happimolekyylien kanssa muodostaen otsonia.
![]()
![]()
otsoni voidaan myös jakaa uudelleen tavalliseksi hapeksi ja happiradikaaliksi absorboimalla ultraviolettivaloa.
![]()
![]()
tätä otsonin muodostumista ja hajoamista tapahtuu koko ajan. Yhdessä nämä reaktiot pysäyttävät paljon ilmakehään tunkeutuvaa haitallista ultraviolettisäteilyä päästäkseen maan pinnalle.
meitä kiinnostava katalyyttinen reaktio tuhoaa otsonin ja estää siten sen absorboimasta UV-säteilyä.
kloorifluorihiilivetyjä (CFC-yhdisteitä) kuten esimerkiksi CF2Cl2: ta käytettiin paljon aerosoleissa ja kylmäaineina. Niiden hidas hajoaminen ilmakehässä tuottaa klooriatomeja-kloorivapaita radikaaleja. Nämä katalysoivat otsonin tuhoutumista.
tämä tapahtuu kahdessa vaiheessa. Ensimmäisessä otsoni hajotetaan ja syntyy uusi vapaa radikaali.
![]()
![]()
klooriradikaalikatalyytti regeneroidaan toisella reaktiolla. Tämä voi tapahtua kahdella tavalla riippuen siitä, osuuko ClO-radikaali otsonimolekyyliin vai happiradikaaliin.
jos se osuu happiradikaaliin (tuotettu yhdestä aiemmin tarkastelemastamme reaktiosta):
![]()
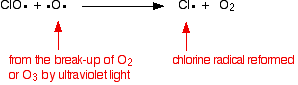
tai jos se osuu otsonimolekyyliin:
![]()
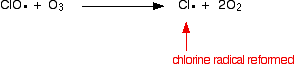
koska klooriradikaali uusiutuu jatkuvasti, jokainen niistä voi tuhota tuhansia otsonimolekyylejä.
Autokatalyysi
etaanidihapon hapettuminen manganaatti (VII) ioneilla
autokatalyysissä reaktiota katalysoi yksi sen tuotteista. Yksi yksinkertaisimmista esimerkeistä tästä on etaanidihappoliuoksen (oksaalihapon) hapetus kaliummanganaatti(VII) – liuoksella (kaliumpermanganaatti).
![]()
![]()
reaktio on huoneenlämmössä hyvin hidas. Sitä käytetään titrauksena kaliummanganaatti(VII) – liuoksen pitoisuuden löytämiseksi ja se suoritetaan yleensä noin 60°C: n lämpötilassa.
reaktiota katalysoivat mangaani (II) ionit. Niitä ei ilmeisesti ole ennen reaktion alkua, joten se alkaa hyvin hitaasti huoneenlämmössä. Yhtälöä tarkastellessa tuotteiden joukosta löytyy kuitenkin mangaani(II) ioneja. Katalyyttiä syntyy yhä enemmän reaktion edetessä ja näin reaktio nopeutuu.
tätä vaikutusta voidaan mitata piirtämällä ajan kuluessa yhden reagoijan pitoisuus. Reaktiolle saadaan normaalista nopeuskäyrästä poikkeava käyrä.
useimmat reaktiot antavat nopeuskäyrän, joka näyttää tältä:
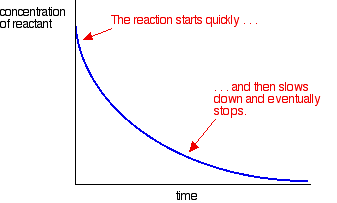
pitoisuudet ovat alussa suuria, joten reaktio on nopea – osoituksena reaktanttipitoisuuden nopea lasku. Kun asiat kuluvat loppuun, reaktio hidastuu ja lopulta pysähtyy, kun yksi tai useampi reagoiva aine kuluu kokonaan loppuun.
esimerkki autokatalyysistä antaa tällaisen käyrän:
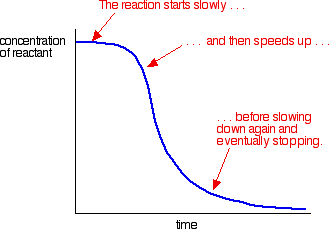
voit nähdä hidas (uncatalysed) reaktio alussa. Kun katalyyttiä alkaa muodostua seoksessa, reaktio kiihtyy-kiihtyy yhä nopeammin, kun katalyyttiä muodostuu yhä enemmän. Lopulta kurssi tietenkin laskee taas, kun tavarat ehtyvät.
Varoitus!
Älä oleta, että nopeuskäyrä, joka näyttää tältä, näyttää välttämättä esimerkkiä autokatalyysistä. On muitakin vaikutuksia, jotka saattavat tuottaa samanlaisen kaavion.
esimerkiksi, jos reaktiossa kiinteä aine reagoi nesteen kanssa, kiinteällä aineella voi olla jonkinlainen pintakerros, jonka nesteen on läpäistävä ennen kuin odotettu reaktio voi tapahtua.
yleisempi mahdollisuus on, että sinulla on voimakas eksoterminen reaktio, etkä hallitse lämpötilaa kunnolla. Reaktion aikana kehittynyt lämpö nopeuttaa reaktiota.