katalyzátory
katalyzátory změnit jedovaté molekuly, jako je oxid uhelnatý a různé oxidy dusíku ve výfukových plynech aut do více jako neškodné molekuly oxidu uhličitého a dusíku. Používají drahé kovy jako platina, palladium a rhodium jako heterogenní katalyzátor.
kovy se ukládají jako tenké vrstvy na keramickou voštinu. To maximalizuje plochu povrchu a udržuje množství použitého kovu na minimum.
reakce mezi oxid uhelnatý a oxid uhelnatý jako typické:
![]()
![]()
katalyzátory mohou být ovlivněny otravě katalyzátoru. K tomu dochází, když se něco, co není součástí reakce, velmi silně adsorbuje na povrch katalyzátoru, což brání dosažení normálních reaktantů.
olovo je známý katalyzátor jed pro katalyzátory. Pokrývá plást drahých kovů a zastaví jeho práci.
v minulosti byly sloučeniny olova přidávány do benzínu (benzín), aby se v motoru spalovalo plynuleji. Ale nemůžete použít katalyzátor, pokud používáte olovnaté palivo. Takže katalyzátory, které pomohli nejen odstranit jedovaté plyny jako oxid uhelnatý a oxidy dusíku, ale také nucené odstranění jedovatých sloučenin olova z benzinu.
použití oxidu vanaditého(v) v procesu kontaktu
během procesu kontaktu pro výrobu kyseliny sírové musí být oxid siřičitý přeměněn na oxid siřičitý. To se provádí průchodem oxidu siřičitého a kyslíku přes pevný katalyzátor oxidu vanadu(V).
![]()
![]()
tento příklad se mírně liší od předchozích, protože plyny skutečně reagují s povrchem katalyzátoru a dočasně jej mění. Je to dobrý příklad schopnosti přechodných kovů a jejich sloučenin působit jako katalyzátory kvůli jejich schopnosti měnit svůj oxidační stav.
oxid siřičitý se oxiduje na oxid siřičitý oxidem vanadu(V). V tomto procesu se oxid vanadu(V) redukuje na oxid vanadu(IV).
![]()
![]()
oxid vanadu(IV) se pak znovu oxiduje kyslíkem.
![]()
![]()
Toto je dobrý příklad způsobu, jakým může být katalyzátor během reakce změněn. Na konci reakce to však bude chemicky stejné, jako to začalo.
homogenní katalýza
to má katalyzátor ve stejné fázi jako reaktanty. Obvykle bude vše přítomno jako plyn nebo obsaženo v jedné kapalné fázi. Příklady obsahují jeden z nich . . .
Příklady homogenní katalýzy
reakce mezi persíran ionty a ionty jodidu
Toto je řešení reakci, která vám může scházet jen v rámci katalýzy, ale to je krásný příklad!
persulfátové ionty (peroxodisulfátové ionty), S2O82 -, jsou velmi silnými oxidačními činidly. Jodidové ionty se velmi snadno oxidují na jód. A přesto je reakce mezi nimi v roztoku ve vodě velmi pomalá.
pokud se podíváte na rovnici, je snadné pochopit, proč to je:
![]()
![]()
reakce vyžaduje kolizi mezi dvěma zápornými ionty. Odpor se tomu vážně postaví do cesty!
katalyzovaná reakce se tomuto problému zcela vyhýbá. Katalyzátorem mohou být buď ionty železa(II) nebo železa(III), které se přidávají do stejného roztoku. Toto je další dobrý příklad použití sloučenin přechodných kovů jako katalyzátorů kvůli jejich schopnosti měnit oxidační stav.
pro argumentaci budeme katalyzátorem považovat ionty železa(II). Jak brzy uvidíte, nezáleží na tom, zda používáte ionty železa(II) nebo železa(III).
persulfátové ionty oxidují ionty železa (II) na ionty železa(III). V tomto procesu jsou persulfátové ionty redukovány na síranové ionty.
![]()
![]()
ionty železa(III) jsou dostatečně silné oxidační činidla k oxidaci jodidových iontů na jod. V tomto procesu jsou opět redukovány zpět na ionty železa(II).
![]()
![]()
obě tyto jednotlivé fáze celkové reakce zahrnují kolizi mezi kladnými a zápornými ionty. To bude mnohem pravděpodobnější, že bude úspěšné než kolize mezi dvěma zápornými ionty v nekatalyzované reakci.
co se stane, pokud použijete ionty železa(III) jako katalyzátor místo iontů železa (II)? Reakce se prostě dějí v jiném pořadí.
zničení atmosférického ozonu
Toto je dobrý příklad homogenní katalýzy, kde je vše přítomno jako plyn.
Ozon, O3, je neustále tvořen a rozešli opět ve vysoké atmosféře působením ultrafialového světla. Obyčejné molekuly kyslíku absorbují ultrafialové světlo a rozpadají se na jednotlivé atomy kyslíku. Ty mají nepárové elektrony a jsou známé jako volné radikály. Jsou velmi reaktivní.
![]()

kyslíkové radikály se pak mohou kombinovat s běžnými molekulami kyslíku a vytvářet ozon.
![]()
![]()
Ozon lze také znovu rozdělit na běžný kyslík a kyslíkový radikál absorbováním ultrafialového světla.
![]()
![]()
tato tvorba a rozpad ozonu se děje po celou dobu. Dohromady tyto reakce zastaví hodně škodlivé ultrafialové záření proniká atmosférou k povrchu Země.
katalytická reakce, o kterou máme zájem, ničí ozon, a tak zabraňuje absorpci UV záření tímto způsobem.
chlorfluoruhlovodíky (CFC), například CF2Cl2, byly široce používány v aerosolech a jako chladiva. Jejich pomalý rozpad v atmosféře vytváří atomy chloru-volné radikály chloru. Ty katalyzují zničení ozonu.
to se děje ve dvou fázích. V prvním se ozon rozpadne a vytvoří se nový volný radikál.
![]()
![]()
katalyzátor chlorových radikálů se regeneruje druhou reakcí. To se může stát dvěma způsoby v závislosti na tom, zda radikál ClO zasáhne molekulu ozonu nebo kyslíkový radikál.
pokud zasáhne kyslíkový radikál (vyrobený z jedné z reakcí, na které jsme se dříve podívali):
![]()
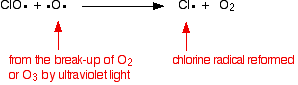
nebo pokud zasáhne molekulu ozonu:
![]()
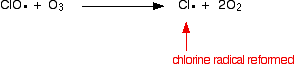
protože chlórový radikál se stále regeneruje, každý z nich může zničit tisíce molekul ozonu.
Autokatalýza
oxidace kyseliny ethanediové ionty manganátu(VII)
při autokatalýze je reakce katalyzována jedním z jejích produktů. Jedním z nejjednodušších příkladů je oxidace roztoku kyseliny ethanediové (kyselina šťavelová) okyseleným roztokem manganátu draselného (VII) (manganistan draselný).
![]()
![]()
reakce je velmi pomalá při pokojové teplotě. Používá se jako titrace k nalezení koncentrace roztoku manganátu draselného (VII) a obvykle se provádí při teplotě asi 60°C. přesto je poměrně pomalé začít.
reakce je katalyzována ionty manganu(II). Zjevně nejsou žádné z přítomných před zahájením reakce, a tak začíná extrémně pomalu při pokojové teplotě. Pokud se však podíváte na rovnici, najdete mezi produkty ionty manganu(II). Stále více katalyzátoru se vyrábí, jak reakce probíhá, a tak se reakce zrychluje.
tento efekt můžete měřit vykreslením koncentrace jednoho z reaktantů v průběhu času. Získáte graf zcela odlišný od křivky normální rychlosti reakce.
Většina reakcí dát hodnotit křivku, která vypadá takto:
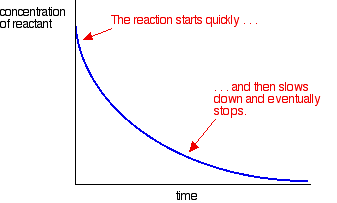
Koncentrace jsou vysoko na začátku, a tak reakce je rychlá – ukazuje rychlý pokles koncentrace reaktantu. Jak se věci zvyknou, reakce se zpomaluje a nakonec se zastaví, protože jeden nebo více reaktantů je zcela vyčerpáno.
příklad autokatalýzy dává křivku jako je tato:
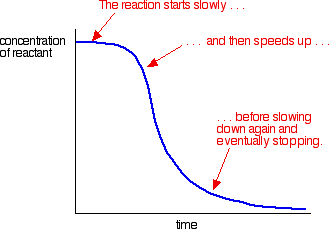
na začátku můžete vidět pomalou (nekatalyzovanou) reakci. Jakmile se ve směsi začne vytvářet katalyzátor, reakce se zrychluje-stále rychleji a rychleji, jak se vytváří stále více katalyzátoru. Nakonec, samozřejmě, sazba opět klesá, jak se věci zvyknou.
varování!
nepředpokládejte, že křivka rychlosti, která vypadá takto, nutně ukazuje příklad autokatalýzy. Existují i další efekty, které by mohly produkovat podobný graf.
například, v případě, že reakce podílející se solidní reaguje s kapalinou, může tam být nějaký druh povrchu povlak na tuhá látka, která kapalina má proniknout před očekávaným reakce se může stát.
běžnější možností je, že máte silně exotermickou reakci a neovládáte správně teplotu. Teplo vyvinuté během reakce urychluje reakci.