katalytiske omformere
katalytiske omformere ændrer giftige molekyler som kulilte og forskellige kvælstofilte i biludstødninger til mere uskadelige molekyler som kulsyre og nitrogen. De bruger dyre metaller som platin, palladium og rhodium som den heterogene katalysator.
metallerne aflejres som tynde lag på en keramisk honningkage. Dette maksimerer overfladearealet og holder den anvendte mængde metal på et minimum.
tager reaktionen mellem kulilte og kvælstofmonilte som typisk:
![]()
![]()
katalysatorer kan påvirkes af katalysatorforgiftning. Dette sker, når noget, der ikke er en del af reaktionen, bliver meget stærkt adsorberet på overfladen af katalysatoren, hvilket forhindrer de normale reaktanter i at nå den.
bly er en velkendt katalysatorgift til katalysatorer. Det belægger honningkagen af dyre metaller og stopper det med at fungere.
tidligere blev blyforbindelser tilsat til brændstof (bensin) for at få det til at brænde mere glat i motoren. Men du kan ikke bruge en katalysator, hvis du bruger blyholdigt brændstof. Så katalysatorer har ikke kun hjulpet med at fjerne giftige gasser som kulilte og kvælstofilter, men har også tvunget fjernelse af giftige blyforbindelser fra brændstof.
anvendelse af vanadium(V) i Kontaktprocessen
under kontaktprocessen til fremstilling af svovlsyre skal svovlsyre omdannes til svovlsyre. Dette gøres ved at føre svovlsyre og ilt over en fast vanadium(V) iltkatalysator.
![]()
![]()
dette eksempel er lidt anderledes end de foregående, fordi gassen faktisk reagerer med overfladen af katalysatoren og ændrer den midlertidigt. Det er et godt eksempel på overgangsmetals og deres forbindelsers evne til at fungere som katalysatorer på grund af deres evne til at ændre deres iltningstilstand.
svovlsyre iltes til svovlsyre af vanadium(V). I denne proces reduceres vanadium(V) til vanadium(IV).
![]()
![]()
vanadium (IV) iltes derefter igen af iltet.
![]()
![]()
dette er et godt eksempel på den måde, hvorpå en katalysator kan ændres i løbet af en reaktion. I slutningen af reaktionen vil det dog være kemisk det samme som det startede.
homogen katalyse
dette har katalysatoren i samme fase som reaktanterne. Typisk vil alt være til stede som en gas eller indeholdt i en enkelt væskefase. Eksemplerne indeholder en af hver af disse . . .
eksempler på homogen katalyse
reaktionen mellem persulfationer og iodidioner
dette er en løsningsreaktion, som du måske kun møder i forbindelse med katalyse, men det er et dejligt eksempel!
Persulfationer (peroksodisulfationer), S2O82-, er meget kraftige iltningsmidler. Iodidioner er meget let iltede til jod. Og alligevel er reaktionen mellem dem i opløsning i vand meget langsom.
hvis man ser på ligningen, er det let at se, hvorfor det er:
![]()
![]()
reaktionen kræver en kollision mellem to negative ioner. Afstødning kommer alvorligt i vejen for det!
den katalyserede reaktion undgår dette problem fuldstændigt. Katalysatoren kan enten være jern(II) eller jern (III) ioner, der tilsættes til den samme opløsning. Dette er et andet godt eksempel på brugen af overgangsmetalforbindelser som katalysatorer på grund af deres evne til at ændre iltningstilstand.
for argumentets skyld tager vi katalysatoren til at være jern(II) ioner. Som du snart vil se, betyder det faktisk ikke noget, om du bruger jern(II) eller jern(III) ioner.
persulfat-ionerne ilter jern(II) – ionerne til jern(III) – ioner. I processen reduceres persulfationerne til sulfationer.
![]()
![]()
jern (III) – ionerne er stærke nok iltningsmidler til at ilte iodidioner til jod. I processen reduceres de tilbage til jern(II) ioner igen.
![]()
![]()
begge disse individuelle stadier i den samlede reaktion involverer kollision mellem positive og negative ioner. Dette vil være meget mere sandsynligt at være vellykket end kollision mellem to negative ioner i den ukatalyserede reaktion.
Hvad sker der, hvis du bruger jern(III) ioner som katalysator i stedet for jern(II) ioner? Reaktionerne sker simpelthen i en anden rækkefølge.
ødelæggelsen af atmosfærisk osomon
dette er et godt eksempel på homogen katalyse, hvor alt er til stede som en gas.
Osomon, O3, bliver konstant dannet og brudt op igen i den høje atmosfære ved hjælp af ultraviolet lys. Almindelige iltmolekyler absorberer ultraviolet lys og bryder ind i individuelle iltatomer. Disse har uparrede elektroner og er kendt som frie radikaler. De er meget reaktive.
![]()

iltradikalerne kan derefter kombineres med almindelige iltmolekyler for at fremstille osomon.
![]()
![]()
det kan også opdeles i almindeligt ilt og en iltradikal ved at absorbere ultraviolet lys.
![]()
![]()
denne oprustning og oprustning foregår hele tiden. Samlet set stopper disse reaktioner en masse skadelig ultraviolet stråling, der trænger ind i atmosfæren for at nå jordens overflade.
den katalytiske reaktion, vi er interesseret i, ødelægger osomonen og stopper den derfor med at absorbere UV på denne måde.
chlorfluorcarboner (CFC ‘ er) som CF2Cl2 blev for eksempel anvendt i vid udstrækning i aerosoler og som kølemidler. Deres langsomme nedbrydning i atmosfæren producerer kloratomer-klorfrie radikaler. Disse katalyserer ødelæggelsen af området.
dette sker i to faser. I den første er området brudt op, og der produceres et nyt frit radikal.
![]()
![]()
den klorradikale katalysator regenereres ved en anden reaktion. Dette kan ske på to måder, afhængigt af om ClO-radikalet rammer et molekyle eller et iltradikal.
hvis det rammer et iltradikal (produceret af en af de reaktioner, vi tidligere har set på):
![]()
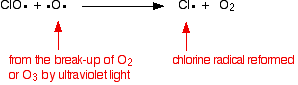
hvis det rammer et molekyle:
![]()
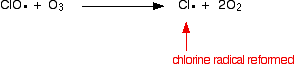
fordi klorradikalet fortsætter med at blive regenereret, kan hver enkelt ødelægge tusindvis af molekyler.
Autokatalyse
iltning af ethandisyre med manganat(VII) ioner
i autokatalyse katalyseres reaktionen af et af dets produkter. Et af de enkleste eksempler på dette er iltning af en opløsning af ethandisyre (oksalinsyre) med en syrnet opløsning af kaliummanganat(VII) (kaliumpermanganat).
![]()
![]()
reaktionen er meget langsom ved stuetemperatur. Det bruges som en titrering til at finde koncentrationen af kaliummanganat (VII) opløsning og udføres normalt ved en temperatur på omkring 60 liter C. alligevel er det ret langsomt at starte med.
reaktionen katalyseres af mangan(II) ioner. Der er naturligvis ikke nogen af dem, der er til stede, før reaktionen starter, og så starter den ekstremt langsomt ved stuetemperatur. Men hvis du ser på ligningen, finder du mangan(II) ioner blandt produkterne. Mere og mere katalysator produceres, når reaktionen fortsætter, og reaktionen accelererer således.
du kan måle denne effekt ved at plotte koncentrationen af en af reaktanterne som tiden går. Du får en graf helt i modsætning til den normale hastighedskurve for en reaktion.
de fleste reaktioner giver en hastighedskurve, der ser sådan ud:
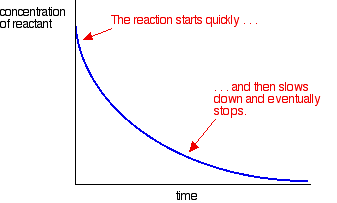
koncentrationerne er høje i begyndelsen, og derfor er reaktionen hurtig – vist ved et hurtigt fald i reaktantkoncentrationen. Efterhånden som tingene bliver brugt op, sænkes reaktionen og stopper til sidst, da en eller flere af reaktanterne er helt opbrugt.
et eksempel på autokatalyse giver en kurve som denne:
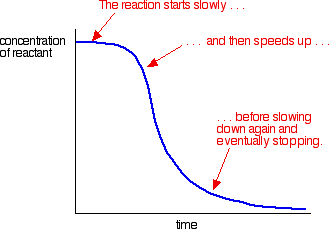
du kan se den langsomme (ukatalyserede) reaktion i begyndelsen. Som katalysator begynder at blive dannet i blandingen, reaktionen hastigheder op – at få hurtigere og hurtigere som mere og mere katalysator dannes. Til sidst, selvfølgelig, satsen falder igen, når tingene bliver brugt op.
advarsel!
Antag ikke, at en hastighedskurve, der ser sådan ud, nødvendigvis viser et eksempel på autokatalyse. Der er andre effekter, der kan producere en lignende graf.
for eksempel, hvis reaktionen involverede et fast stof, der reagerede med en væske, kan der være en slags overfladebelægning på det faste stof, som væsken skal trænge igennem, før den forventede reaktion kan ske.
en mere almindelig mulighed er, at du har en stærkt eksoterm reaktion og ikke styrer temperaturen korrekt. Den varme, der udvikles under reaktionen, fremskynder reaktionen.