Convertisseurs catalytiques
Les convertisseurs catalytiques transforment des molécules toxiques comme le monoxyde de carbone et divers oxydes d’azote dans les gaz d’échappement des voitures en molécules plus inoffensives comme le dioxyde de carbone et l’azote. Ils utilisent des métaux coûteux comme le platine, le palladium et le rhodium comme catalyseur hétérogène.
Les métaux sont déposés sous forme de couches minces sur un nid d’abeilles en céramique. Cela maximise la surface et réduit au minimum la quantité de métal utilisée.
Prenant la réaction entre le monoxyde de carbone et le monoxyde d’azote comme typique:
![]()
![]()
Les convertisseurs catalytiques peuvent être affectés par l’empoisonnement du catalyseur. Cela se produit lorsque quelque chose qui ne fait pas partie de la réaction est très fortement adsorbé à la surface du catalyseur, empêchant les réactifs normaux de l’atteindre.
Le plomb est un poison catalytique familier pour les convertisseurs catalytiques. Il recouvre le nid d’abeilles de métaux coûteux et l’arrête de fonctionner.
Dans le passé, des composés de plomb étaient ajoutés à l’essence (essence) pour la rendre plus douce dans le moteur. Mais vous ne pouvez pas utiliser de convertisseur catalytique si vous utilisez du carburant au plomb. Ainsi, les convertisseurs catalytiques ont non seulement aidé à éliminer les gaz toxiques comme le monoxyde de carbone et les oxydes d’azote, mais ont également forcé l’élimination des composés toxiques du plomb de l’essence.
Utilisation de l’oxyde de vanadium (V) dans le Procédé de contact
Pendant le Procédé de contact pour la fabrication de l’acide sulfurique, le dioxyde de soufre doit être converti en trioxyde de soufre. Ceci est fait en faisant passer du dioxyde de soufre et de l’oxygène sur un catalyseur solide à l’oxyde de vanadium (V).
![]()
![]()
Cet exemple est légèrement différent des précédents car les gaz réagissent réellement avec la surface du catalyseur, la modifiant temporairement. C’est un bon exemple de la capacité des métaux de transition et de leurs composés à agir comme catalyseurs en raison de leur capacité à modifier leur état d’oxydation.
Le dioxyde de soufre est oxydé en trioxyde de soufre par l’oxyde de vanadium (V). Dans le procédé, l’oxyde de vanadium (V) est réduit en oxyde de vanadium (IV).
![]()
![]()
L’oxyde de vanadium (IV) est ensuite ré-oxydé par l’oxygène.
![]()
![]()
C’est un bon exemple de la façon dont un catalyseur peut être modifié au cours d’une réaction. À la fin de la réaction, cependant, ce sera chimiquement le même qu’il a commencé.
Catalyse homogène
Le catalyseur est dans la même phase que les réactifs. Typiquement, tout sera présent sous forme de gaz ou contenu dans une seule phase liquide. Les exemples contiennent un de chacun de ceux-ci. . .
Exemples de catalyse homogène
La réaction entre les ions persulfates et les ions iodure
C’est une réaction en solution que vous ne pouvez bien rencontrer que dans le cadre de la catalyse, mais c’est un bel exemple!
Les ions persulfates (ions peroxodisulfates), S2O82-, sont des agents oxydants très puissants. Les ions iodure sont très facilement oxydés en iode. Et pourtant, la réaction entre eux en solution dans l’eau est très lente.
Si vous regardez l’équation, il est facile de voir pourquoi c’est:
![]()
![]()
La réaction nécessite une collision entre deux ions négatifs. La répulsion va sérieusement gêner cela!
La réaction catalysée évite complètement ce problème. Le catalyseur peut être soit des ions fer (II), soit des ions fer (III) qui sont ajoutés à la même solution. C’est un autre bon exemple d’utilisation de composés de métaux de transition comme catalyseurs en raison de leur capacité à changer d’état d’oxydation.
Pour des raisons d’argument, nous prendrons le catalyseur pour être des ions fer (II). Comme vous le verrez bientôt, peu importe que vous utilisiez des ions fer (II) ou fer (III).
Les ions persulfates oxydent les ions fer (II) en ions fer (III). Dans le processus, les ions persulfates sont réduits en ions sulfate.
![]()
![]()
Les ions fer (III) sont des agents oxydants suffisamment puissants pour oxyder les ions iodure en iode. Dans le processus, ils sont à nouveau réduits en ions fer (II).
![]()
![]()
Ces deux étapes individuelles de la réaction globale impliquent une collision entre les ions positifs et négatifs. Cela aura beaucoup plus de chances de réussir que la collision entre deux ions négatifs dans la réaction non catalysée.
Que se passe-t-il si vous utilisez des ions fer (III) comme catalyseur au lieu des ions fer (II)? Les réactions se produisent simplement dans un ordre différent.
La destruction de l’ozone atmosphérique
C’est un bon exemple de catalyse homogène où tout est présent sous forme de gaz.
L’ozone, O3, se forme et se décompose constamment dans la haute atmosphère sous l’action de la lumière ultraviolette. Les molécules d’oxygène ordinaires absorbent la lumière ultraviolette et se divisent en atomes d’oxygène individuels. Ceux-ci ont des électrons non appariés et sont connus sous le nom de radicaux libres. Ils sont très réactifs.
![]()

Les radicaux oxygénés peuvent alors se combiner avec des molécules d’oxygène ordinaires pour produire de l’ozone.
![]()
![]()
L’ozone peut également être divisé à nouveau en oxygène ordinaire et en un radical oxygène en absorbant la lumière ultraviolette.
![]()
![]()
Cette formation et cette désintégration de l’ozone se produisent tout le temps. Prises ensemble, ces réactions empêchent de nombreux rayons ultraviolets nocifs de pénétrer dans l’atmosphère pour atteindre la surface de la Terre.
La réaction catalytique qui nous intéresse détruit l’ozone et l’empêche ainsi d’absorber les UV.
Les chlorofluorocarbures (CFC) comme le CF2Cl2, par exemple, ont été largement utilisés dans les aérosols et comme réfrigérants. Leur dégradation lente dans l’atmosphère produit des atomes de chlore – des radicaux libres de chlore. Ceux-ci catalysent la destruction de l’ozone.
Cela se produit en deux étapes. Dans le premier, l’ozone est brisé et un nouveau radical libre est produit.
![]()
![]()
Le catalyseur radicalaire chloré est régénéré par une seconde réaction. Cela peut se produire de deux manières selon que le radical ClO frappe une molécule d’ozone ou un radical oxygène.
S’il frappe un radical oxygéné (produit à partir de l’une des réactions que nous avons examinées précédemment):
![]()
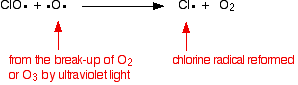
Ou s’il frappe une molécule d’ozone:
![]()
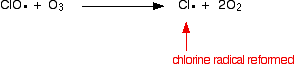
Parce que le radical chlore continue à se régénérer, chacun peut détruire des milliers de molécules d’ozone.
Autocatalyse
L’oxydation de l’acide éthanedioïque par les ions manganate (VII)
En autocatalyse, la réaction est catalysée par l’un de ses produits. L’un des exemples les plus simples est l’oxydation d’une solution d’acide éthanedioïque (acide oxalique) par une solution acidifiée de manganate de potassium (VII) (permanganate de potassium).
![]()
![]()
La réaction est très lente à température ambiante. Il est utilisé comme titrage pour trouver la concentration en solution de manganate de potassium (VII) et est généralement effectué à une température d’environ 60 ° C. Néanmoins, il est assez lent au départ.
La réaction est catalysée par des ions manganèse (II). Il n’y a évidemment aucune de ces personnes présentes avant le début de la réaction, et donc elle démarre extrêmement lentement à température ambiante. Cependant, si vous regardez l’équation, vous trouverez des ions manganèse (II) parmi les produits. De plus en plus de catalyseur est produit au fur et à mesure que la réaction se déroule et la réaction s’accélère.
Vous pouvez mesurer cet effet en traçant la concentration de l’un des réactifs au fil du temps. Vous obtenez un graphique assez différent de la courbe de taux normale pour une réaction.
La plupart des réactions donnent une courbe de taux qui ressemble à ceci:
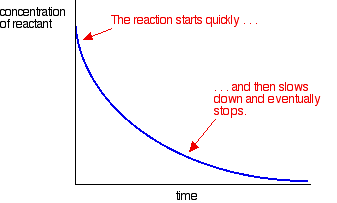
Les concentrations sont élevées au début et la réaction est donc rapide, comme en témoigne une chute rapide de la concentration en réactif. Au fur et à mesure que les choses s’épuisent, la réaction ralentit et finit par s’arrêter car un ou plusieurs des réactifs sont complètement épuisés.
Un exemple d’autocatalyse donne une courbe comme celle-ci:
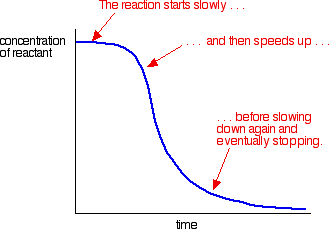
Vous pouvez voir la réaction lente (non catalysée) au début. Lorsque le catalyseur commence à se former dans le mélange, la réaction s’accélère – devenant de plus en plus rapide à mesure que de plus en plus de catalyseur se forme. Finalement, bien sûr, le taux diminue à nouveau à mesure que les choses s’épuisent.
Attention!
Ne supposez pas qu’une courbe de taux qui ressemble à ceci montre nécessairement un exemple d’autocatalyse. Il existe d’autres effets qui pourraient produire un graphique similaire.
Par exemple, si la réaction impliquait la réaction d’un solide avec un liquide, il pourrait y avoir une sorte de revêtement de surface sur le solide que le liquide doit pénétrer avant que la réaction attendue puisse se produire.
Une possibilité plus courante est que vous ayez une réaction fortement exothermique et que vous ne contrôlez pas correctement la température. La chaleur qui a évolué au cours de la réaction accélère la réaction.