触媒コンバータ
触媒コンバータは、一酸化炭素や車の排気中の様々な窒素酸化物のような有毒な分子を、二酸化炭素や窒素のようなよ それらは不均質触媒として白金、パラジウムおよびロジウムのような高い金属を使用します。
金属はセラミックハニカム上に薄い層として堆積されます。 これは表面積を最大にし、最低に使用される金属の量を保つ。
一酸化炭素と一酸化窒素の反応を代表的なものとする:
![]()
![]()
触媒コンバータは、触媒中毒の影響を受ける可能性があります。 これは、反応の一部ではないものが触媒の表面に非常に強く吸着され、通常の反応物が触媒に到達するのを防ぐときに起こります。
鉛は触媒コンバーターのためのよく知られた触媒の毒である。 それは高い金属の蜜蜂の巣に塗り、働くことを停止します。
過去には、ガソリン(ガソリン)に鉛化合物を添加して、エンジン内でよりスムーズに燃焼させました。 しかし、加鉛燃料を使用している場合は、触媒コンバータを使用することはできません。 したがって、触媒コンバータは、一酸化炭素や窒素酸化物のような有毒ガスを除去するのに役立つだけでなく、ガソリンから有毒な鉛化合物を除去す
接触プロセスにおける酸化バナジウム(V)の使用
硫酸を製造するための接触プロセス中に、二酸化硫黄を三酸化硫黄に変換する必要があります。 これは固体バナジウム(V)酸化物の触媒上の二酸化硫黄そして酸素を渡すことによってされます。
![]()
![]()
この例は、ガスが実際に触媒の表面と反応して一時的に変化するため、以前の例とはわずかに異なります。 これは、遷移金属およびそれらの化合物がそれらの酸化状態を変化させる能力のために触媒として作用する能力の良い例である。
二酸化硫黄は酸化バナジウム(V)によって三酸化硫黄に酸化される。 この過程で、酸化バナジウム(V)は酸化バナジウム(IV)に還元される。
![]()
![]()
酸化バナジウム(IV)は酸素によって再酸化される。
![]()
![]()
これは、反応の過程で触媒を変化させることができる方法の良い例である。 しかし、反応の終わりには、それが始まったのと化学的に同じになります。
均質触媒
これは反応物と同じ相の触媒を有する。 典型的には、すべてが気体として存在するか、または単一の液相に含まれる。 例には、これらのそれぞれの1つが含まれています。 . .
均質触媒の例
過硫酸イオンとヨウ化物イオンの反応
これは触媒作用の文脈でしか会うことができない溶液反応ですが、素敵な例です!
過硫酸イオン(ペルオキソ二硫酸イオン)、S2O82-は非常に強力な酸化剤です。 ヨウ化物イオンはヨウ素に非常に容易に酸化されます。 しかし、水中の溶液中でのそれらの間の反応は非常に遅い。
方程式を見ると、なぜそれがあるのか分かりやすいです:
![]()
![]()
この反応には二つの負イオンの衝突が必要である。 その邪魔になると本気で反発してくるぞ!
触媒反応はこの問題を完全に回避する。 触媒は、同じ溶液に添加される鉄(I I)または鉄(III)イオンのいずれかであり得る。 これは、酸化状態を変化させる能力のために、遷移金属化合物を触媒として使用するもう一つの良い例である。
議論のために、触媒を鉄(II)イオンとする。 あなたがすぐに見るように、それは実際にあなたが鉄(II)または鉄(III)イオンを使用するかどうかは問題ではありません。
過硫酸イオンは鉄(II)イオンを鉄(III)イオンに酸化する。 このプロセスでは、過硫酸イオンは硫酸イオンに還元される。
![]()
![]()
鉄(III)イオンは、ヨウ化物イオンをヨウ素に酸化するのに十分強い酸化剤である。 その過程で、それらは再び鉄(II)イオンに還元される。
![]()
![]()
全面的な反作用のこれらの個々の段階の両方は肯定的な、否定的なイオン間の衝突を含みます。 これは、未触媒反応における二つの負イオン間の衝突よりもはるかに成功する可能性が高い。
鉄(II)イオンの代わりに鉄(III)イオンを触媒として使用するとどうなりますか? 反応は単に異なる順序で起こります。
大気中のオゾンの破壊
これは、すべてがガスとして存在する均質な触媒作用の良い例です。
オゾン、O3は、紫外線の作用によって高い大気中で常に形成され、再び分解されています。 通常の酸素分子は紫外線を吸収し、個々の酸素原子に侵入します。 これらは不対電子を持ち、フリーラジカルとして知られています。 彼らは非常に反応性があります。
![]()

酸素基は通常の酸素の分子とオゾンを作るためにそれから結合できます。
![]()
![]()
オゾンはまた、紫外線を吸収することによって通常の酸素と酸素ラジカルに再び分割することができます。
![]()
![]()
オゾンのこの形成そして分割はいつも起こっている。 まとめると、これらの反応は、地球の表面に到達するために大気を貫通する有害な紫外線の多くを停止します。
私たちが興味を持っている触媒反応はオゾンを破壊するので、このようにして紫外線を吸収するのを止めます。
Cf2Cl2のようなクロロフルオロカーボン(Cfc)は、エアロゾルや冷媒として広く使用されていました。 大気中でのそれらのゆっくりとした分解は、塩素原子-塩素フリーラジカルを生成する。 これらはオゾンの破壊を触媒する。
これは2つの段階で発生します。 最初に、オゾンは破壊され、新しい遊離基は作り出されます。
![]()
![]()
塩素ラジカル触媒は、第二の反応によって再生される。 これは、ClOラジカルがオゾン分子または酸素ラジカルに当たるかどうかに応じて2つの方法で起こることができます。
それが酸素ラジカルに当たった場合(以前に見た反応の一つから生成される):
![]()
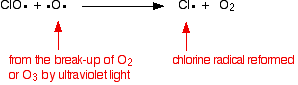
またはオゾン分子に当たった場合:
![]()
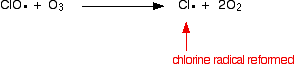
塩素ラジカルは再生され続けるので、それぞれが何千ものオゾン分子を破壊する可能性があります。
自己触媒
マンガン酸塩(VII)イオンによるエタン二酸の酸化
自己触媒では、反応はその生成物の一つによって触媒される。 これの最も単純な例の1つは、マンガン酸カリウム(VII)(過マンガン酸カリウム)の酸性化溶液によるエタン二酸(シュウ酸)の溶液の酸化である。
![]()
![]()
反応は室温で非常に遅い。 マンガン酸カリウム(VII)溶液の濃度を見つけるための滴定として使用され、通常は約60℃の温度で行われます。
反応はマンガン(II)イオンによって触媒される。 明らかに反応が始まる前に存在するものは存在しないので、室温で非常にゆっくりと始まります。 しかし、方程式を見ると、生成物の中にマンガン(II)イオンがあります。 反応が進行するにつれて、より多くの触媒が生成されるので、反応がスピードアップします。
時間が経つにつれて反応物の一つの濃度をプロットすることによって、この効果を測定することができます。 あなたは非常に反応のための通常の速度曲線とは異なり、グラフを取得します。
ほとんどの反応は次のような速度曲線を与えます:
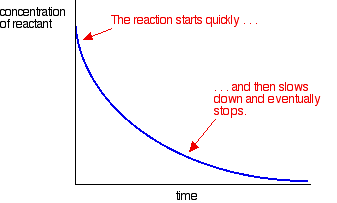
濃度は初めに高いので、反応は反応物濃度の急速な低下によって速く示される。 物事が使い果たされるにつれて、反応が遅くなり、反応物の一つ以上が完全に使い果たされるにつれて最終的に停止します。
自己触媒の例では、次のような曲線が得られます:
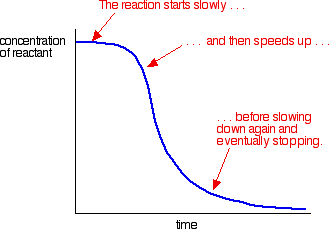
あなたは最初に遅い(分析されていない)反応を見ることができます。 触媒が混合物中に形成され始めると、反応はスピードアップし、より多くの触媒が形成されるにつれてより速く、より速くなる。 結局、当然、率は事が使用されて得ると同時に再度落ちる。
警告!
このようなレート曲線が必ずしも自己触媒の例を示すと仮定しないでください。 同様のグラフを生成する可能性のある他の効果があります。
例えば、反応に固体と液体との反応が含まれる場合、予想される反応が起こる前に液体が浸透しなければならない固体に何らかの表面コーティングが
より一般的な可能性は、強い発熱反応があり、温度を適切に制御していないということです。 反応中に発生した熱は反応を加速させる。