conversores Catalíticos
conversores Catalíticos alterar venenosas moléculas como monóxido de carbono e vários óxidos de nitrogênio no carro esgota em mais inofensivo moléculas como o dióxido de carbono e de nitrogênio. Eles usam metais caros como platina, paládio e ródio como o catalisador heterogêneo.
os metais são depositados como camadas finas num bloco cerâmico alveolado. Isto maximiza a área de superfície e mantém a quantidade de metal usada ao mínimo.
tomar a reacção entre o monóxido de carbono e o monóxido de azoto como típico:
![]()
![]()
catalisadores podem ser afetados por envenenamento catalisador. Isto acontece quando algo que não é uma parte da reação fica fortemente adsorvido na superfície do catalisador, impedindo os reagentes normais de alcançá-lo.
chumbo é um veneno catalisador familiar para catalisadores. Cobre o favo de mel de metais caros e pára de funcionar.
no passado, compostos de chumbo foram adicionados à gasolina (gasolina) para torná-lo queimar mais suavemente no motor. Mas você não pode usar um catalisador se você estiver usando combustível com chumbo. Assim, os catalisadores não só ajudaram a remover gases venenosos como o monóxido de carbono e os óxidos de azoto, como também forçaram a remoção de compostos de chumbo venenosos da gasolina.
a utilização de óxido de vanádio(V) no processo de contacto
durante o processo de contacto para o fabrico de ácido sulfúrico, o dióxido de enxofre Tem de ser convertido em trióxido de enxofre. Isto é feito passando dióxido de enxofre e oxigênio sobre um sólido catalisador de óxido de vanádio(V).
![]()
![]()
este exemplo é ligeiramente diferente dos anteriores porque os gases realmente reagem com a superfície do catalisador, mudando-o temporariamente. É um bom exemplo da capacidade dos metais de transição e seus compostos para agir como catalisadores por causa de sua capacidade de mudar seu estado de oxidação.
o dióxido de enxofre é oxidado a trióxido de enxofre pelo óxido de vanádio(V). No processo, o óxido de vanádio(V) é reduzido a óxido de vanádio(IV).
![]()
![]()
o óxido de vanádio (IV) é então re-oxidado pelo oxigénio.
![]()
![]()
este é um bom exemplo de como um catalisador pode ser alterado durante o curso de uma reação. No final da reação, porém, será quimicamente o mesmo que começou.
catálise homogénea
isto tem o catalisador na mesma fase que os reagentes. Normalmente tudo estará presente como um gás ou contido em uma única fase líquida. Os exemplos contêm um de cada um deles . . .
exemplos de catálise homogénea
a reacção entre iões de persulfato e iões de iodeto
esta é uma reacção de solução que só se pode encontrar no contexto da catálise, mas é um belo exemplo!
iões Persulfato (iões peroxodissulfato), S2O82-, são agentes oxidantes muito poderosos. Iões de iodeto são facilmente oxidados em iodo. E ainda assim a reação entre eles em solução na água é muito lenta.
se você olhar para a equação, é fácil ver por que isso é:
![]()
![]()
a reacção precisa de uma colisão entre dois iões negativos. Repulsão vai ficar seriamente no caminho disso!
a reacção catalisada evita completamente esse problema. O catalisador pode ser iões de ferro(II) ou de ferro(III) que são adicionados à mesma solução. This is another good example of the use of transition metal compounds as catalysts because of their ability to change oxidation state.
para o bem do argumento, vamos tomar o catalisador para ser íons de ferro(II). Como você verá em breve, não importa se você usa íons de ferro(II) ou ferro(III).
os iões persulfato oxidam os iões de ferro(II) em iões de ferro(III). No processo os íons persulfato são reduzidos a íons sulfatos.
![]()
![]()
os iões de ferro (III) são suficientemente fortes para oxidar iões de iodeto em iodo. No processo, eles são reduzidos de volta ao ferro (II) ions novamente.
![]()
![]()
ambos os estágios individuais na reação global envolvem colisão entre íons positivos e negativos. Isso será muito mais provável de ser bem sucedido do que a colisão entre dois íons negativos na reação não paralisada.
o que acontece se você usar íons de ferro(III) como catalisador em vez de íons de ferro(II)? As reações simplesmente acontecem em uma ordem diferente.
a destruição do ozono atmosférico
este é um bom exemplo de catálise homogénea onde tudo está presente como gás.
Ozônio, O3, está constantemente sendo formado e quebrado novamente na alta atmosfera pela ação da luz ultravioleta. As moléculas de oxigénio comuns absorvem a luz ultravioleta e dividem-se em átomos de oxigénio individuais. Estes têm elétrons não emparelhados, e são conhecidos como radicais livres. Eles são muito reativos.
![]()

os radicais de oxigênio podem então combinar-se com moléculas de oxigênio comuns para fazer ozônio.
![]()
![]()
o ozônio também pode ser dividido novamente em oxigênio comum e um radical de oxigênio absorvendo luz ultravioleta.
![]()
![]()
esta formação e destruição do ozono está sempre a acontecer. Em conjunto, estas reacções impedem que muita radiação ultravioleta nociva penetre na atmosfera para atingir a superfície da Terra.
a reação catalítica em que estamos interessados destrói o ozônio e assim o impede de absorver UV desta forma.
Clorofluorocarbonetos (CFC) como CF2Cl2, por exemplo, foram usados extensivamente em aerossóis e como refrigerantes. A sua lenta degradação na atmosfera produz átomos de cloro-radicais livres de cloro. Estes catalisam a destruição do ozono.
isto acontece em duas fases. Na primeira, o ozônio é quebrado e um novo radical livre é produzido.
![]()
![]()
o catalisador radical de cloro é regenerado por uma segunda reação. Isto pode acontecer de duas maneiras dependendo se o radical ClO atinge uma molécula de ozônio ou um radical de oxigênio.Se atingir um radical de oxigénio (produzido a partir de uma das reacções que vimos anteriormente)):
![]()
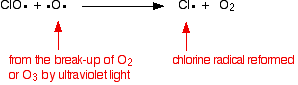
ou se atingir uma molécula de ozono:
![]()
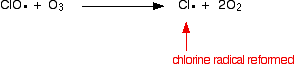
como o cloro radical continua a ser regenerado, cada um pode destruir milhares de moléculas de ozono.
Autocatálise
a oxidação do ácido etanodióico por iões manganatos(VII)
em autocatálise, a reacção é catalisada por um dos seus produtos. Um dos exemplos mais simples disso é a oxidação de uma solução de ácido etanodióico (ácido oxálico) por uma solução acidificada de manganato de potássio(VII) (permanganato de potássio).
![]()
![]()
a reacção é muito lenta à temperatura ambiente. É usado como titulação para encontrar a concentração da solução de manganato de potássio(VII) e é geralmente realizado a uma temperatura de cerca de 60°C. Mesmo assim, é bastante lento para começar.
a reacção é catalisada por iões de manganês(II). Obviamente não há nenhum desses presentes antes da reação começar, e assim começa extremamente lentamente à temperatura ambiente. No entanto, se você olhar para a equação, você vai encontrar iões de manganês (II) entre os produtos. Cada vez mais catalisador é produzido à medida que a reação prossegue e assim a reação acelera.
pode medir este efeito traçando a concentração de um dos reagentes à medida que o tempo passa. Você tem um gráfico bastante diferente da curva de taxa normal para uma reação.
a maioria das reacções dá uma curva de taxa que se parece com esta:
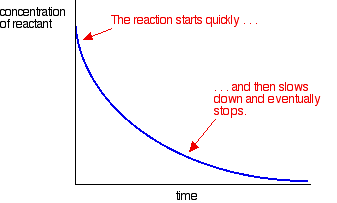
as concentrações são elevadas no início e, por isso, a reacção é rápida – mostrada por uma queda rápida na concentração dos reagentes. À medida que as coisas se esgotam, a reação diminui e, eventualmente, pára como um ou mais reagentes são completamente usados.
um exemplo de autocatálise dá uma curva como esta:
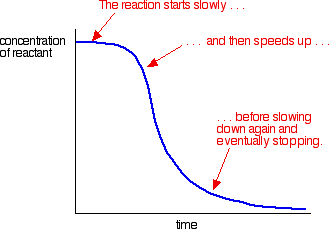
você pode ver a reação lenta (não paralisada) no início. À medida que o catalisador começa a ser formado na mistura, a reação acelera – se cada vez mais rápido à medida que cada vez mais catalisador é formado. Eventualmente, é claro, a taxa cai novamente à medida que as coisas se esgotam.Aviso!
não assumir que uma curva de taxa que se parece com isso necessariamente mostra um exemplo de autocatálise. Existem outros efeitos que podem produzir um gráfico semelhante.
por exemplo, se a reacção envolver uma reacção sólida com um líquido, pode haver algum tipo de revestimento superficial no sólido que o líquido tem de penetrar antes que a reacção esperada possa acontecer.
uma possibilidade mais comum é que você tem uma reação fortemente exotérmica e não estão controlando a temperatura corretamente. O calor evoluiu durante a reação acelera a reação.