En química, el punto de anequivalencia es un término que se usa al realizar la titulación. Aplica a cualquier reacción ácido-base o de neutralización técnicamente.
Definición:
El punto de equivalencia de una reacción química es el punto en el que se mezclan químicamente cantidades iguales de reactivos.
En otras palabras, durante la valoración, es un punto en el que la cantidad de valorante agregado es suficiente para neutralizar la solución de analito por completo. El número de moles de titrante es decir, la solución patrón es igual a los lunares de una solución que tiene una concentración desconocida. También se conoce como punto estequiométrico porque es un punto donde los moles de ácido son iguales a los moles de la base que se necesitan para neutralizar la solución. Tenga en cuenta que la relación ácido-base no tiene que ser de 1:1. Esta relación ácido-base se explica por la ecuación química equilibrada ácido-base. Se pueden utilizar indicadores para este fin, por ejemplo, naranja de metilo o fenolftaleína.

El punto de equivalencia no puede tomarse del mismo modo que el punto final de una valoración. El punto final se refiere al punto en el que el indicador usado cambia de color. Estos cambios de color aparecen después de alcanzar el punto de equivalencia. Si usamos el punto final para determinar la equivalencia, inducirá un error.
Métodos de determinación del Punto de Equivalencia:
Existen diferentes métodos para la determinación del punto de equivalencia. Se discuten a continuación:
- indicador de pH
- Conductancia
- Cambio de Color
- Precipitación
- calorimetría Isotérmica
- Termométrico titulación
- Espectroscopia
- Amperometría
indicador de pH:
apH indicador es una sustancia química que cambia de color en la reacción a anychemical cambio. Un indicador ácido-base, por ejemplo, la fenolftaleína cambia de color, lo que depende de su pH. También se pueden usar indicadores Redox para este propósito. Inicialmente, solo se agrega una gota de solución indicadora a la captura. El cambio de color mostrará que se ha alcanzado el punto final.Se trata de una estimación del punto de equivalencia.
Conductancia:
La conductividad eléctrica de una solución se ve afectada por los iones. Por lo tanto, la conductividad cambia cuando reaccionan entre sí. (por ejemplo, al realizar una titulación ácido-base, los iones H3O+ y OH – reaccionan y forman agua neutra, solución H20). La conductancia es un método relativamente difícil de operar, especialmente cuando los iones que están presentes en la solución pueden participar en la conductividad. La conductancia se puede utilizar para algunas acciones de base ácida.
Cambio de color:
En el punto de equivalencia, la solución cambiará su color de forma natural sin adición de un indicador en algunas reacciones. Esto se puede observar en metales de transición donde el estado de oxidación consiste en diferentes colores.
Precipitación:
Durante la titulación, el precipitado se formará si la reacción forma un sólido. Un buen ejemplo de precipitación es la reacción entre plata, Ag+ y Cloro, Cl-que resulta en la formación de una sal insoluble, Cloruro de plata, AgCl. Inesperadamente, esto hace que sea muy difícil determinar los puntos finales con precisión debido al tamaño de las partículas, la velocidad de sedimentación y el color hacen que sea muy difícil de ver. Esta es la razón por la cual la valoración de la captación se realiza como valoraciones retrospectivas.
Calorimetría isotérmica:
La determinación del punto de equivalencia se realiza calculando la cantidad de calor que se produce o absorbe utilizando un dispositivo conocido como calorímetro de titulación isotérmica. Este tipo se usa generalmente en titulaciones que involucran reacciones bioquímicas, es decir, como unión enzimática.
Titrimetría termométrica:
La termometría es una técnica excepcionalmente multifacética. En este caso, el punto de equivalencia se determina midiendo la tasa de cambio de temperatura producido por la reacción química. Esta propiedad la diferencia de la calorimetrictitrimetría. Debido a que la titulación termométrica es una técnica relativa, no es necesario realizar la titulación en condiciones isotérmicas. Este tipo de extracción se puede realizar en plásticos o incluso en recipientes de vidrio. Para evitar corrientes de aire, estos recipientes generalmente están encerrados causando cualquier ruido que perturbe el punto final. Debido a la capacidad de este tipo de titulación para realizarse en condiciones ambientales, son apropiados para el proceso rutinario y el control de calidad en la industria. La temperatura aumentará o disminuirá durante el proceso de valoración, dependiendo de si la reacción que se produce entre el valorante y el analito es exotérmica o endotérmica. Ittitación cuando todo el analito ha sido consumido por la reacción, la velocidad de los cambios de temperatura es decir. un aumento o disminución determina el punto de equivalencia y la inflexión en la curva de temperatura se puede observar. El punto de equivalencia se puede observar con precisión empleando la segunda derivada de la curva de temperatura. El software que se utiliza en un sistema de titulación termométrica automatizado moderno consiste en algoritmos digitales avanzados regulares para que el ruido generado por sondas de temperatura altamente sensibles no cause interferencia alguna con la aparición de un pico secundario uniforme y regular que describe el punto final. Esta técnica tiene la capacidad de una precisión muy alta y el coeficiente de varianza (CVs) de menos de 0,1 es usual. Las últimas sondas de temperatura de titulación termométrica tienen un termistor que forma un brazo de un puente de Wheatstone. el mejor sistema de valoración termométrica puede resolver la temperatura a 10-5 K si se acopla a electrónica de alta resolución. Si los cambios de temperatura durante la valoración se vuelven tan pequeños como 0,001 K, se obtendrá un punto de equivalencia nítido. Cuando hay un cambio en la alcalinidad, esta técnica se puede aplicar necesariamente a cualquier reacción química en un fluido, aunque la cinética de reacción juega un papel importante en el cálculo de la nitidez del punto final. Este punto de titulación se ha aplicado sustancialmente a la titulación ácido-base, EDTA, REDOX y precipitación. Las muestras importantes de titulación de precipitación incluyen:
- Sulfatetitración con iones de bario
- Fosfatetitración con Magnesio en solución de amonio
- Cloridetitración con nitrato de plata
- Nickeltitración con Dimetilglioxima
- Fluoridetitración con aluminio (como K2NaAlF6)
Las titulaciones no acuosas se pueden realizar fácilmente como titulaciones acuosas porque la sonda de temperatura no requiere estar conectada eléctricamente a la solución, como se requiere en las titulaciones potenciométricas. Las soluciones que son muy turbias o coloreadas se pueden analizar fácilmente por termometría sin ningún otro tratamiento de una muestra. La sonda no requiere mantenimiento. Ahora, al utilizar las buretas accionadas por motor paso a paso más recientes y altamente precisas,las valoraciones termométricas se completan en pocos minutos, lo que convierte a esta técnica en una elección perfecta cuando se necesita una alta producción en un laboratorio.
Espectroscopia:
en este tipo, la espectroscopia se utiliza para determinar el punto de equivalencia si se conoce el espectro del reactivo, producto o valorante. Se utiliza una cantidad específica del producto y del reactivo para encontrar el punto de equivalencia. También se puede determinar un nivel muy bajo de presencia del reactivo de valoración gratuito. En resumen, este método se utiliza para determinar la existencia de semiconductores.
Amperometría:
Amperometría es una técnica de detección que se utiliza para medir el cambio en la corriente.La amperometría se utiliza principalmente en las titulaciones en las que se puede reducir el exceso de valorante. Este método es útil al valorar un haluro con Ag + porque la formación de precipitados no se verá afectada.
Ejemplos de punto de equivalencia:
- La reacción de un ácido fuerte con una base fuerte:
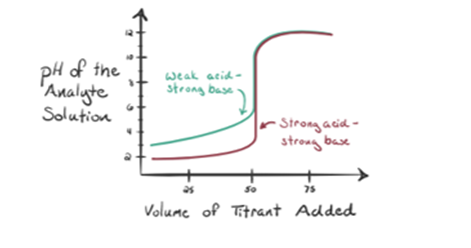
Supongamos que el ácido clorhídrico HCl (un ácido fuerte) se toma como un analito y el hidróxido de sodio NaOH (base fuerte) se toma como un valorante. Si trazamos un gráfico entre el pH del analito y un valorante NaOH que se puede agregar desde la bureta, se formará un gráfico de valoración como se muestra a continuación:
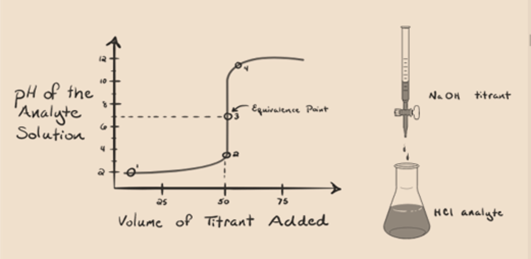
Figura 1.1
La figura 1.1 anterior muestra en el punto 1 que cuando no se agrega una base como NaOH. El pH del analito es bajo, ya que contiene principalmente H3O + de la separación de HCl.

A medida que se agrega hidróxido de sodio NaOH gota a gota, comienza a ser absorbido por OH– lentamente que se produce por disociación de NaOH. El analito producido será ácido debido a la presencia dominante de iones de hidronio, H3O+.
En la figura 1.1, el punto 2 indica el punto de tiempo en el que se registra el pH justo antes de que la neutralización tenga lugar por completo. Mientras que el punto 3 nos muestra el punto de equivalencia. Aquí los moles de hidróxido de sodio añadidos son iguales a los moles del cloruro de hidroxilo en el analito. Este es el punto donde los iones de hidronio, H3O+, son completamente neutralizados por el ion hidroxilo, OH–. El pH de la solución es neutro, es decir, pH = 7 porque tiene sal, NaCl y agua H2O.
El punto 4 de la figura 1.1 muestra que a medida que seguimos agregando NaOH, el pH de la solución comienza a ser básico debido a la neutralización completa del HCl. Ahora hay muchos iones OH-presentes en la solución que se disocia del NaOH.
- Reacción de un ácido débil con una base fuerte:
Consideremos un ácido débil, un ácido acético CH3COOH y una base fuerte de hidróxido de sodio NaOH como valorante. Si trazamos un gráfico entre el pH del analito y el volumen de NaOH, obtendremos una curva de titulación como se muestra a continuación.
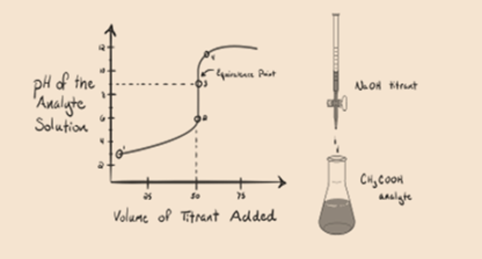
La Figura 1.2
La Figura 1.2 muestra en el punto 1 que el NaOH no se ha añadido todavía, por lo que en este momento el pH del analito es bajo, ya que contiene principalmente H3O+ cuando CH3COOH se disocia. Pero como el ácido acético es un ácido débil, por lo tanto, inicialmente su pH será más alto.

A medida que seguimos agregando NaOH de forma gota a gota, H3O + comenzará a ser absorbido por OH– lentamente. Esto será producido por la disociación de NaOH. Pero aquí el analito sigue siendo ácido debido a la presencia de iones H3O+en su mayoría.
Infigure 1.2 punto 2 indica el pH registrado en un momento justo antes de que la aneutralización se lleve a cabo por completo.
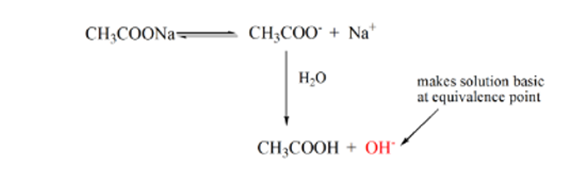
El punto 3 representa el punto de equivalencia. Este es el punto donde los moles de NaOH son iguales a los moles de CH3COOH en un analito. Los iones hidronio son completamente neutralizados por los iones hidroxilo. La solución contendrá entonces sal de CH3COONa y H2O.

Nota:
Puede notar una diferencia aquí en comparación con un caso 1 con a que tiene un ácido fuerte titulado contra una base fuerte. En este caso (ácido débil y una base fuerte), el pH no es neutro en un punto de equivalencia. La solución es tener un pH~9 en el punto de equivalencia. Vamos a averiguar la razón a continuación.
De la ecuación anterior, se muestra que la solución contiene CH3COONa en el punto de equivalencia. Esto se disocia en iones de sodio y iones de acetato. El ion acetato es la base conjugada del ácido débil CH3COOH. Por lo tanto, CH3COO– es una base relativamente fuerte (es decir, el ácido débil tiene una base conjugada fuerte), por lo tanto, reaccionan con el agua para producir iones hidróxido que aumentan el pH a cerca de 9 en el punto de equivalencia.
El punto 4 de la figura 1.2 muestra que cuando el hidróxido de sodio está en mayor cantidad, la curva de titulación ganada será idéntica a la del HCl-NaOH.
- Ácido fuerte con una base débil:
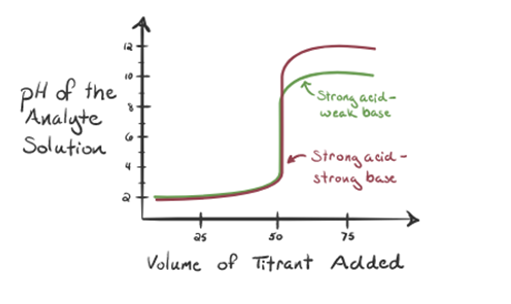
Aquí, consideremos el ácido clorhídrico como un ácido fuerte como analito y el amoníaco como una base débil como valorante. Si trazamos un gráfico entre el pH de la solución de analito y el volumen del valorante NH3, obtendremos una curva de valoración como se indica a continuación:
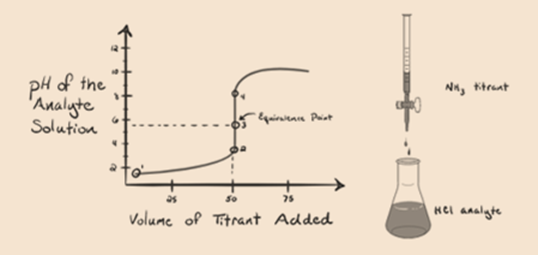
La figura 1.3
De la figura 1.3, punto 1, muestra que cuando no se añade amoníaco, el pH del analito será bajo, ya que contiene principalmente H3O+ de la disociación del ácido clorhídrico.
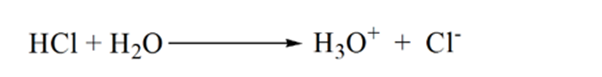
A medida que se agrega amoníaco gota a gota, el H3O+ comienza a ser consumido por el amoníaco lentamente. El analito seguirá siendo ácido debido a la mayoría de los iones H3O+.
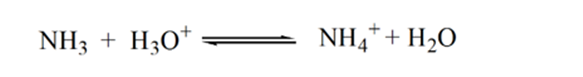
El punto 2 de la figura 1.3 indica que el pH se registra en un punto justo antes de que la aneutralización tenga lugar por completo.
El punto 3 muestra el punto de equivalencia. Aquí el número de moles de NH3 añadido es igual a los moles de HCl en el analito. Los iones de hidronio son completamente neutralizados por NH3.
Nota:
Se ha observado que en el caso de la base débil contra un ácido fuerte, el pH no es neutro en el punto de equivalencia. Por lo tanto, la solución que se logra será ácida, con un pH de alrededor de 5,5 en el punto de equivalencia.
La razón de esto es que en un punto de equivalencia la solución solo tiene iones de amonio NH4+ e iones de cloruro, CL-. Como los iones de amonio son el ácido conjugado de una base débil, es decir, NH3. Por lo tanto, el NH4+ es un ácido fuerte y, por lo tanto, el NH4+ reaccionará con el agua para producir iones de hidronio, lo que hace que la solución sea ácida.
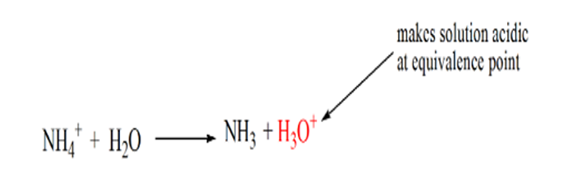
El punto 4 muestra que después de alcanzar un punto de equivalencia, seguiremos agregando amoníaco y cuando esté en exceso, el pH comenzará a aumentar. El amoníaco es una base débil, por lo que su pH está por encima de 7, pero es igual de bajo en comparación con una base fuerte NaOH mostrada en el caso 1.
- Base débil con un ácido débil:
Consideremos el amoníaco, una base débil como analito y un ácido acético que es un ácido débil como valorante. Si trazamos un gráfico entre el pH de la solución de analito versus el volumen del ácido acético como valorante, obtendremos una curva de valoración como se muestra a continuación:
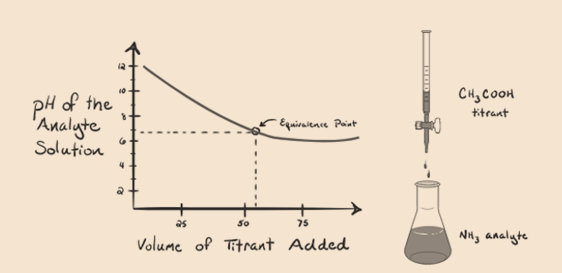
Figura 1.4
Hemos notado que no hay pendiente en este gráfico. Esto es lo que llamamos un»punto de inflexión» en el punto de equivalencia. La ausencia de un cambio brusco en el pH requerido no nos da mucha información a través de tal curva.