In chimica, punto di anequivalenza è un termine che viene utilizzato durante l’esecuzione di titolazione. Appliesto qualsiasi reazione acido-base o neutralizzazione tecnicamente.
Definizione:
Il punto di equivalenza di una reazione chimica è il punto in cui quantità uguali di reagenti sono mescolate chimicamente.
In altre parole, durante la titolazione, è un punto in cui la quantità di titolante aggiunto è sufficiente per neutralizzare completamente la soluzione di analita. Il numero di moli di titolante cioè la soluzione standard è uguale alle talpe di una soluzione con una concentrazione sconosciuta. È anche noto come punto stechiometrico perché è un punto in cui le talpe di acido sono uguali alle talpe della base che sono necessarie per neutralizzare la soluzione. Si noti che il rapporto acido / base non deve essere 1: 1. Questo rapporto acido-base è spiegato dall’equazione chimica acido-base bilanciata. Gli indicatori possono essere utilizzati per questo scopo, ad esempio, metil arancio o fenolftaleina.

Il punto di equivalenza non può essere preso come l’endpoint di una titolazione. L’endpoint isreferred a come il punto in cui l’indicatore utilizzato cambia il suo colore. Thesecolor modifiche appaiono dopo aver raggiunto il punto di equivalenza. Se usiamo theendpoint per determinare l’equivalenza, indurrà un errore.
Metodi di determinazione del punto di equivalenza:
Esistono diversi metodi per la determinazione del punto di equivalenza. Sono discussi comefollows:
- indicatore pH
- Conduttanza
- Cambiamento di Colore
- Precipitazione
- calorimetria Isotermica
- Termometriche e titolazioni
- Spettroscopia
- Amperometria
indicatore pH:
apH indicatore è una sostanza chimica che cambia il suo colore in reazione a anychemical cambiare. Un indicatore acido-base, ad esempio, la fenolftaleina cambia il suo colore che dipende dal suo pH. Gli indicatori Redox possono essere utilizzati anche per questo scopo. Inizialmente, viene aggiunta solo una singola goccia di soluzione indicatoretitrazione. Il cambiamento di colore mostrerà che l’endpoint è stato raggiunto.Questa sarà una stima del punto di equivalenza.
Conduttanza:
La conduttività elettrica di una soluzione è influenzata dagli ioni. Quindi ilconduttività cambia quando reagiscono l’uno con l’altro. (ad esempio, mentre si esegue una titolazione acido-base, gli ioni H3O+ e OH reagiscono e formano acqua neutra, soluzione H20). La conduttanza è relativamente un metodo difficileperato, specialmente quando gli ioni che sono presenti nella soluzione possonopartecipare alla conduttività. La conduttanza può essere utilizzata per alcuni acidi basareazioni.
Cambiamento di colore:
Athe punto di equivalenza, la soluzione cambierà il suo colore naturalmente senza anyaddition di un indicatore in alcune reazioni. Questo può essere osservato in transizionemetalli in cui lo stato di ossidazione è costituito da diversi colori.
Precipitazione:
Durante la titolazione, il precipitato si formerà ifthe reazione forma un solido. Un buon esempio di precipitazione è la reazione tra argento, Ag + e cloro, Cl-che si traduce nella formazione di sale insolubile, cloruro d’argento, AgCl. Inaspettatamente, questo rende molto difficile determinare gli endpoint con precisione a causa della dimensione delle particelle, il tasso di ossidazione e il colore lo rendono molto difficile da vedere. Questo è il motivo whyprecipitation titolazione è fatto come titolazioni posteriori.
Calorimetria isotermica:
La determinazione del punto di equivalenza viene effettuata calcolando la quantità di calore prodotta o assorbita utilizzando un dispositivo noto come calorimetro di titolazione isotermica. Questo tipo è usato solitamente nelle titolazioni che coinvolgono biochemicalreactions cioè, come legame enzimatico.
Titrimetria termometrica:
La titrimetria termometrica è una tecnica eccezionalmente multiforme. Qui l’equivalenzapunto è determinato misurando la velocità di variazione di temperatura prodotta dalla reazione achemica. Questa proprietà lo differenzia dalla calorimetritrimetria. Poiché la titrimetria termometrica è una tecnica relativa, non è necessario eseguire la titolazione in condizioni isotermiche. Questo tipo dititrazione può essere condotta in plastica o anche in vasi di vetro. Per preventstray correnti d’aria, queste navi sono di solito racchiusi causando qualsiasi rumore thatdisturbs l’endpoint. A causa della capacità di questo tipo di titolazione di beconducted in condizioni ambientali, sono appropriati per il controllo di qualità processand di routine nel settore. La temperatura aumenterà o diminuirà durante il processo di titolazione, a seconda che la reazione tra il titolante e l’analita sia esotermica o endotermica. Ittration quando tutto l’analita è stato consumato dalla reazione, il tasso oftemperature cambia cioè. un aumento o una diminuzione determina l’equivalenzapunto e inflessione nella curva di temperatura possono essere osservati. Il punto di equivalenza può essere osservato precisamente impiegando la derivata seconda della curva di temperatura. Il software che viene utilizzato in un moderno sistema di titolazione termometrica automatizzata è costituito da algoritmi digitali avanzati regolari in modo che il rumore generato da sonde di temperatura altamente sensibili non causi alcuna interferenza con l’aspetto di un picco di seconda generazione regolare e uniforme che descrive l’endpoint. Questa tecnica ha la capacità di altissima precisione e il coefficiente di varianza (CVs) inferiore a 0,1 areusual. Le ultime sonde di temperatura di titolazione termometrica hanno un termistoreche forma un braccio di un ponte di Wheatstone. il miglior sistema di titolazione termometrica può risolvere la temperatura a 10-5 K se accoppiato ad alta risoluzione elettronica. Se la temperatura cambia durante l’esecuzione della titolazione diventa aslittle come 0.001 K si otterrà un punto di equivalenza acuto. In caso di cambiamento di entalpia, questa tecnica può essere applicata necessariamente a qualsiasi reazione chimica in un fluido, sebbene la cinetica di reazione svolga un ruolo importante nel calcolo della nitidezza dell’endpoint. Questo punto di titrimetria è stato sostanzialmente applicato alla titolazione acido-base, EDTA, REDOX e precipitazione. Gli esempi importanti di titolazione delle precipitazioni includono:
- Sulfatetitration con ioni di Bario
- Phosphatetitration con il Magnesio, ammonio soluzione
- Chloridetitration con Nitrato d’argento
- Nickeltitration con Dimethylglyoxime
- Fluoridetitration con l’Alluminio (come K2NaAlF6)
Asnon acquosa titolazioni può essere facilmente effettuata come acquosa di titolazione becausethe sonda di temperatura non richiede di essere collegato elettricamente a thesolution necessario titolazioni potenziometriche. Le soluzioni che arehighly torbide o colorate possono essere analizzate facilmente da termometrico senza trattamento anyfurther di un campione. La sonda è esente da manutenzione. Ora un giorno byusing le burette azionate motore passo-passo più recenti e altamente précised,le titolazioni termometriche sono completate in pochi minuti, rendendo thistechnique una scelta perfetta dove alta produzione in un laboratorio è necessaria.
Spettroscopia:
in questo tipo, la spettroscopia viene utilizzata per determinare il punto di equivalenza se lo spettro del reagente, del prodotto o del titolante è noto. Una quantità specifica del prodottoe reagente viene utilizzata per trovare il punto di equivalenza. Si può anche determinare un livello molto basso della presenza del titolante libero. In breve, questo metodo è usatoper determinare l’esistenza di semiconduttori.
Amperometria:
Amperometria è una tecnica di rilevamento che viene utilizzata per misurare il cambiamento nella corrente.L’amperometria è principalmente utilizzata in quelle titolazioni in cui il titolante in eccesso può essere ridotto. Questo metodo è utile durante la titolazione di un alogenuro con Ag + perché la formazione dei precipitati non sarà influenzata.
Esempi di punto di equivalenza:
- La reazione di un acido forte con una base forte:
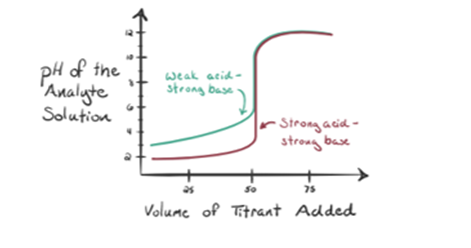
Supponiamo che l’acido cloridrico HCl (un acido forte) sia preso come analita e che l’idrossido di sodio NaOH (base forte) sia preso come titolante. Se tracciamo un grafico tra l’analita pH e un titolante NaOH che può essere aggiunto dalla buretta, si formerà un grafico di titolazione come indicato di seguito:
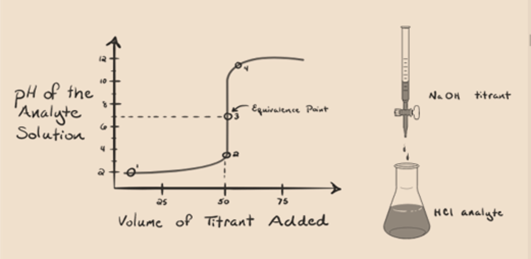
Figura 1.1
La figura 1.1 sopra mostra al punto 1 che quando non viene aggiunta alcuna base come NaOH. Il pH dell’analita è basso in quanto contiene principalmente H3O + dalla separazione di HCl.

Come idrossido di sodio NaOH viene aggiunto goccia bydrop, inizia a essere assorbito da OH-lentamente che viene prodotto bydissociation di NaOH. L’analita prodotto sarà acido a causa del dominantepresenza di ioni idronio, H3O+.
Nella figura 1.1 il punto 2 indica il momento in cui il pH viene registrato poco prima che la neutralizzazione abbia luogo completamente. Mentre il punto 3 ci mostra il punto di equivalenza. Qui le talpe di idrossido di sodio aggiunte sono uguali alle talpe del cloruro di idrossile nell’analita. Questo è il punto in cui gli ioni idronio, H3O+ sono completamente neutralizzati dallo hydrox idrossile, OH -. Il pH della soluzione è neutro cioè pH = 7 perché ha sale, NaCl e acqua H2O.
Il punto 4 della figura 1.1 mostra che mentre continuiamo ad aggiungere NaOH, il pH della soluzione inizia a diventare fondamentale a causa della completa neutralizzazione dell’HCl. Ora ci sono un sacco di ioni OH sono presenti nella soluzione che si dissocia da NaOH.
- La reazione di un acido debole con una base forte:
Consideriamo un acido debole, un acido acetico CH3COOH e un idrossido di sodio a base forte NaOH come titolante. Se tracciamo un grafico tra il pH dell’analita e il volume di NaOH, otterremo una curva di titolazione come mostrato di seguito.
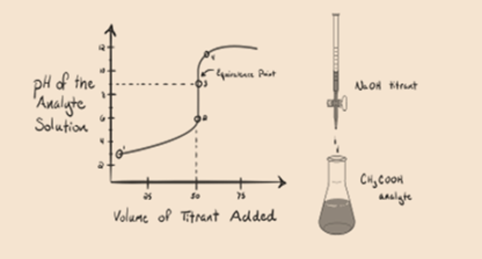
Figura 1.2
Figura 1.2 mostra al punto 1 che NaOH non è ancora aggiunto, quindi in questo momento il pH dell’analita è basso in quanto contiene principalmente H3O+ quando CH3COOH si dissocia. Ma poiché l’acido acetico è un acido debole, quindi inizialmente il suo pH sarà più alto.

Aswe continuare ad aggiungere NaOH goccia a goccia, H3O + inizierà gettingconsumed da OH-lentamente. Questo sarà prodotto dalla dissociazione di NaOH. Ma qui l’analita è ancora acido a causa della presenza di ioni H3O+principalmente.
Infigure 1.2 il punto 2 indica il pH registrato alla volta poco prima che l’aneutralizzazione avvenga completamente.
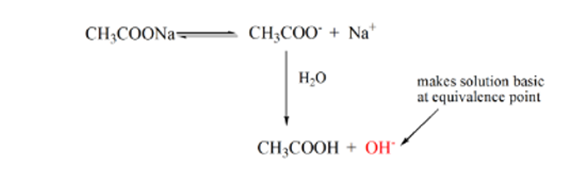
Il punto 3 rappresenta il punto di equivalenza. Questo è il punto in cui le talpe di NaOH sono uguali alle talpe di CH3COOH in un analita. Gli ioni idronio sono completamente neutralizzati dagli ioni idrossile. La soluzione conterrà quindi CH3COONa sale e H2O.

Nota:
Youcan notare una differenza qui rispetto a un caso 1 con un avente un strongacid titolato contro una base forte. In questo caso (acido debole e un fortebase), il pH non è neutro in un punto di equivalenza. La soluzione è havinga pH ~ 9 al punto di equivalenza. Scopriamo il motivo qui sotto.
Dall’equazione precedente, viene mostrato che la soluzione contiene CH3COONa nel punto di equivalenza. Questo si dissocia in ioni sodio e ioni acetato. Lo Acetate acetato è la base coniugata dell’acido debole CH3COOH. Quindi, CH3COO – è relativamente una base forte (cioè l’acido debole ha una forte base coniugata) quindi reagiscono con l’acqua per produrre ioni idrossido che aumentano il pH vicino a 9 nel punto di equivalenza.
Il punto 4 della figura 1.2 mostra che quando l’idrossido di sodio è in quantità maggiore, la curva di titolazione acquisita sarà identica a HCl-NaOH.
- Strongacid con una base debole:
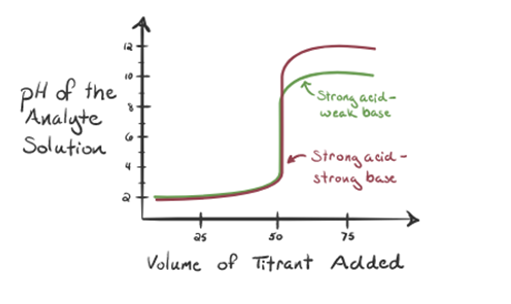
Qui, consideriamo l’acido cloridrico come acido forte come analita e l’ammoniaca come base debole come titolante. Se riportiamo in un grafico che il pH della soluzione di analita e il volume di titolante NH3, si ottiene una curva di titolazione, come indicato di seguito:
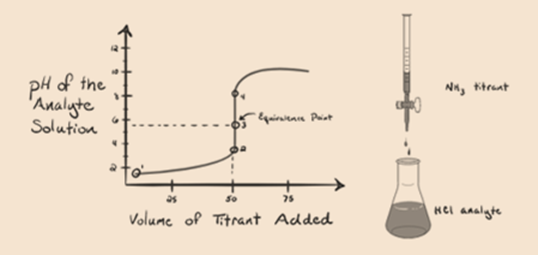
Figura 1.3
In figura 1.3, punto 1, mostra che quando non viene aggiunta ammoniaca, il pH dell’analita sarà basso come per lo più contiene H3O+ dalla dissociazione di acido Cloridrico.
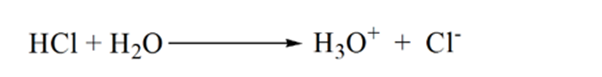
Poiché l’ammoniaca viene aggiunta goccia a goccia, H3O + inizia a consumarsi lentamente dall’ammoniaca. L’analita sarà ancora acido a causa della maggior parte degli ioni H3O+.
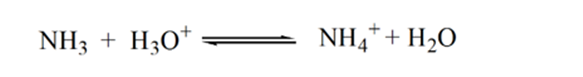
Il punto 2 della figura 1.3 indica che il pH viene registrato in un punto appena prima che l’aneutralizzazione avvenga completamente.
Point3 mostra il punto di equivalenza. Qui il numero di talpe di NH3 aggiuntoè uguale alle talpe di HCl nell’analita. Gli ioni idronio sono fullyneutralized da NH3.
Nota:
Si nota che nel caso della base debole contro un acido forte, il pH non è neutro nel punto di equivalenza. Quindi la soluzione che viene raggiuntasarà acido con un pH intorno a 5,5 nel punto di equivalenza.
La ragione di ciò è che in un punto di equivalenza la soluzione ha solo ioni ammonio NH4+ e ioni cloruro, CL-. Come gli ioni di ammonio sono l’acido coniugato di una base debole cioè NH3. Pertanto, NH4 + è un acido forte e quindi NH4 + reagirà con acqua per produrre ioni idronio che rende la soluzione acida.
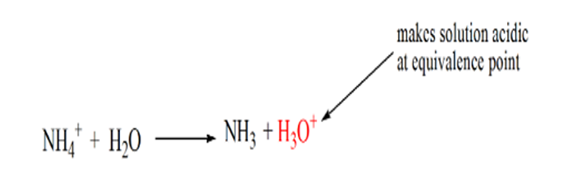
Il punto 4 mostra che dopo aver raggiunto un punto di equivalenza, continueremo ad aggiungere ammoniaca e quando in eccesso, il pH inizierà ad aumentare. L’ammoniaca è una base debole, quindi il suo pH è superiore a 7, ma è più basso rispetto a una base forte NaOH mostrata nel caso 1.
- Weakbase con un acido debole:
Consideriamo l’ammoniaca, una base debole come analita e un acido acetico che è un acido debole come titolante. Se tracciamo un grafico tra il pH della soluzione di analita rispetto al volume dell’acido acetico come titolante, otterremo una curva di titolazione come di seguito:
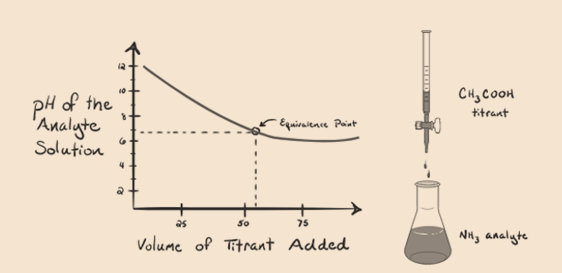
Figura 1.4
Abbiamo notato che non c’è ripida in questo grafico grafico. Questo è ciò che chiamiamo un “punto di inflessione” al punto di equivalenza. L’assenza di therequired ripida variazione di pH non ci dà molte informazioni attraverso tale acurve.