in de chemie is een equivalentiepunt een term die wordt gebruikt tijdens het uitvoeren van titratie. Het is technisch van toepassing op een zuur-base-of neutralisatiereactie.
definitie:
het equivalentiepunt van een chemische reactie is het punt waarop gelijke hoeveelheden reagentia chemisch worden gemengd.
met andere woorden, tijdens het titreren is het een punt waar de hoeveelheid toegevoegde titrant voldoende is om de analyt-oplossing volledig te neutraliseren. Het aantal mol van titrant d.w.z. de standaardoplossing is gelijk aan de Mol van een oplossing met een onbekende concentratie. Het is ook bekend als het stoichiometrische punt omdat het een punt is waar de Mol van zuur gelijk is aan de Mol van de base die nodig zijn om de oplossing te neutraliseren. Merk op dat de zuur / base verhouding niet 1:1 hoeft te zijn. Deze zuur-base verhouding wordt verklaard door de gebalanceerde zuur-base chemische vergelijking. Indicatoren kunnen hiervoor worden gebruikt, bijvoorbeeld methyloranje of fenolftaleïne.

het equivalentiepunt kan niet hetzelfde worden genomen als het eindpunt van een titratie. Het eindpunt wordt aangeduid als het punt waarop de gebruikte indicator zijn kleur verandert. Deze kleurveranderingen verschijnen na het bereiken van het equivalentiepunt. Als we het eindpunt gebruiken om gelijkwaardigheid te bepalen, zal het een fout veroorzaken.
methoden voor het bepalen van het equivalentiepunt:
er zijn verschillende methoden voor het bepalen van het equivalentiepunt. Zij worden als volgt besproken:
- pH-indicator
- geleidbaarheid
- kleurverandering
- precipitatie
- isothermische calorimetrie
- thermometrische titrimetrie
- spectroscopie
- Amperometrie
pH-indicator:
APH-indicator is een chemische stof die zijn kleur verandert als reactie op een chemische verandering. Een zuur-base indicator, bijvoorbeeld, fenolftaleïne verandert zijn kleur die afhankelijk is van de pH. Redox indicatoren kunnen ook worden gebruikt voor dit doel. In eerste instantie wordt slechts een enkele druppel indicator oplossing toegevoegd aan detitratie. De kleurverandering zal laten zien dat het eindpunt is bereikt.Dit is een schatting van het equivalentiepunt.
geleidbaarheid:
de elektrische geleidbaarheid van een oplossing wordt beïnvloed door de ionen. Vandaar dat degeleiding verandert wanneer ze met elkaar reageren. (bijvoorbeeld, terwijl het uitvoeren van een zuur – base titratie, reageert de H3O+, en OH-ionen en vormenneutraal water, H20-oplossing). Geleidbaarheid is relatief een moeilijke methode teperate, vooral wanneer de ionen die aanwezig zijn in de oplossing kunnen deelnemen aan geleidbaarheid. Geleidbaarheid kan worden gebruikt voor een paar zuur-basereacties.
kleurverandering:
op het equivalentiepunt verandert de oplossing van nature zonder toevoeging van een indicator in sommige reacties. Dit kan worden waargenomen in transitiemetalen waar de oxidatietoestand uit verschillende kleuren bestaat.
neerslag:
tijdens titratie zal het neerslag ontstaan als de reactie een vaste stof vormt. Een goed voorbeeld van precipitatie is de reactie tussen zilver, Ag+, en chloor, Cl – die resulteert in de vorming van een niet-oplosbaar zout, zilverchloride, AgCl. Onverwacht, maakt dit het zeer moeilijk om de eindpunten nauwkeurig wegens deeltjesgrootte te bepalen, maakt de snelheid van edimentatie en kleur het zeer moeilijk om te zien. Dit is de reden waarom de titratie van de precipitatie als achtertitraties wordt gedaan.
isothermische calorimetrie:
de bepaling van het equivalentiepunt wordt gedaan door de hoeveelheid warmte te berekenen die wordt geproduceerd of geabsorbeerd met behulp van een apparaat dat bekendstaat als een isothermische titratiecalorimeter. Dit type wordt gewoonlijk gebruikt in titraties die biochemicalreactions d.w.z., als enzymband impliceren.
thermometrische Titrimetrie:
Thermometrictitrimetrie is een bijzonder veelzijdige techniek. Hier wordt het equivalencepunt bepaald door de snelheid van temperatuurverandering te meten die door een chemische reactie wordt veroorzaakt. Deze eigenschap onderscheidt het van calorimetrictitrimetrie. Omdat thermometrische titrimetrie een relatieve techniek is, is het niet nodig om de titratie onder isothermische omstandigheden uit te voeren. Dit type titratie kan worden uitgevoerd in kunststoffen of zelfs in glazen vaten. Deze schepen worden meestal ingesloten door het veroorzaken van lawaai dat het eindpunt verstoort. Omdat dit type titratie onder omgevingsomstandigheden kan worden geleid, zijn ze geschikt voor routinematige proces-en kwaliteitscontrole in de industrie. De temperatuur zal tijdens het titratieproces toenemen of verminderen, afhankelijk van of de reactie tussen de titrant en analyt exotherm of endotherm is. Ittitration wanneer al analyte door de reactie is verbruikt, tarief van temperatuurveranderingen d.w.z. een toename of afname bepaalt het equivalencepoint en buiging in de temperatuurcurve kan worden waargenomen. Het equivalentiepunt kan precies worden waargenomen door gebruik te maken van de tweede afgeleide van de temperatuurcurve. De software die wordt gebruikt in een modern geautomatiseerd thermometrisch titratiesysteem bestaat uit regelmatige geavanceerde digitale algoritmen, zodat het geluid dat wordt gegenereerd door zeer gevoelige temperatuursondes geen interferentie veroorzaakt met het verschijnen van een regelmatige, uniforme secondderivatieve piek die het eindpunt beschrijft. Deze techniek heeft het vermogen van zeer hoge precisie en de variantiecoëfficiënt (CVs) van minder dan 0,1 is usual. De nieuwste thermometrische titratietemperatuursondes hebben een thermistor die één arm vormt van een Wheatstone-Brug. het beste thermometrische titratiesysteem kan de temperatuur tot 10-5 K oplossen Indien gekoppeld aan high-resolutionelectronics. Als de temperatuur verandert tijdens het uitvoeren van titratie even klein wordt als 0,001 K zal een scherp equivalentiepunt worden verkregen. Waar er een enthalpyverandering is, kan deze techniek noodzakelijkerwijs op om het even welke chemische reactie in een vloeistof worden toegepast, hoewel de reactiekinetiek een belangrijke rol in het berekenen van de scherpte van het eindpunt speelt. Dit punt van titrimetrie is substantieel toegepast op zuur-base, EDTA, REDOX en precipitatie titratie. Belangrijke voorbeelden van precipitatietitratie zijn::
- Sulfatetitratie met Bariumionen
- Fosfatetitratie met Magnesium in ammoniumoplossing
- Chloridetitratie met zilvernitraat
- Nickeltitratie met Dimethylglyoxim
- Fluoridetitratie met aluminium (als K2NaAlF6))
als niet-waterige titraties kunnen gemakkelijk als waterige titratie worden uitgevoerd omdat de temperatuursonde niet elektrisch met de oplossing moet worden verbonden aangezien het in potentiometrische titraties wordt vereist. De oplossingen die zeer troebel of gekleurd zijn kunnen gemakkelijk door thermometrisch zonder anyfurther behandeling van een steekproef worden geanalyseerd. De sonde is onderhoudsvrij. Nu een dag door gebruik te maken van de nieuwste en zeer précised stepper motor aangedreven buretten,thermometrische titraties worden voltooid binnen een paar minuten, waardoor thistechnique een perfecte keuze waar hoge productie in een laboratorium nodig is.
spectroscopie:
bij dit type wordt spectroscopie gebruikt om het equivalentiepunt te bepalen als het spectrumvan de reactant, het product of de titrant bekend is. Een specifieke hoeveelheid van het product en de reactant wordt gebruikt om het equivalentiepunt te vinden. Een zeer laag niveau van de aanwezigheid van de vrije titrant kan ook worden bepaald. Kortom, deze methode wordt gebruikt om het bestaan van halfgeleiders te bepalen.
Amperometrie:
Amperometrie is een detectietechniek die wordt gebruikt om de verandering in de stroom te meten.Amperometrie wordt meestal gebruikt in die titraties waar de overtollige titrant kan worden verminderd. Deze methode is nuttig terwijl het titreren van een halide met Ag + omdat de vorming van precipitaten niet zal worden beïnvloed.
voorbeelden van equivalentiepunt:
- de reactie van een sterk zuur met een sterke base:
stel dat zoutzuur HCl (een sterk zuur) als analyt wordt ingenomen en natriumhydroxide NaOH (sterke base) als titrant. Als we een grafiek plotten tussen analyte pH en een titrant NaOH die kan worden toegevoegd uit de buret, zal een titratiegrafiek worden gevormd zoals hieronder wordt gegeven:
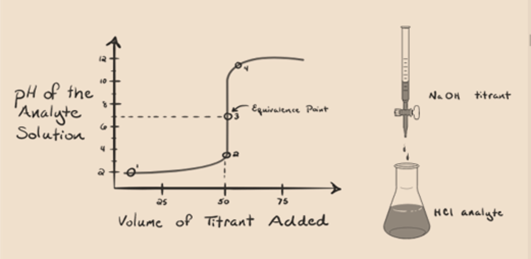
figuur 1.1
bovenstaande figuur 1.1 laat op punt 1 zien dat wanneer er geen base als NaOH wordt toegevoegd. De pH van de analyt is laag aangezien het meestal H3O+ van de scheiding van HCl bevat.

als natriumhydroxide NaOH druppelgedruppel wordt toegevoegd, begint het te worden geabsorbeerd door OH-langzaam dat wordt geproduceerd door deissociatie van NaOH. De geproduceerde analyt zal zuur zijn vanwege de dominantpresentie van hydroniumionen, H3O+.
in figuur 1.1 geeft punt 2 het tijdstip aan waarop de pH wordt geregistreerd vlak voordat de neutralisatie volledig plaatsvindt. Terwijl punt 3 Ons het equivalentiepunt toont. Hier is de Mol toegevoegd natriumhydroxide gelijk aan de Mol van het hydroxylchloride in de analyt. Dit is het punt waar hydroniumionen, H3O+ volledig worden geneutraliseerd door hydroxylion, OH -. De pH van de oplossing is neutraal, d.w.z. pH = 7 omdat het zout, NaCl en water H2O bevat.
punt 4 van figuur 1.1 laat zien dat als we NaOH blijven toevoegen, de pH van de oplossing basisch begint te worden door de volledige neutralisatie van HCl. Nu zijn er tal van OH-ionen aanwezig in de oplossing die zich distantieert van NaOH.
- de reactie van een zwak zuur met een sterke base:
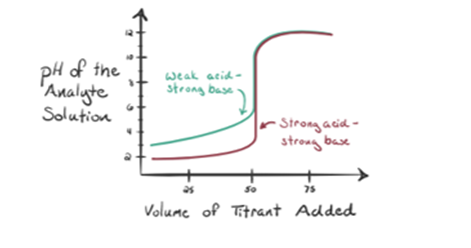
laten we een zwak zuur, een azijnzuur CH3COOH en een sterke natriumhydroxide NaOH als titrant beschouwen. Als we een grafiek plotten tussen de pH van de analyt en het volume van NaOH, krijgen we een titratiecurve zoals hieronder getoond.
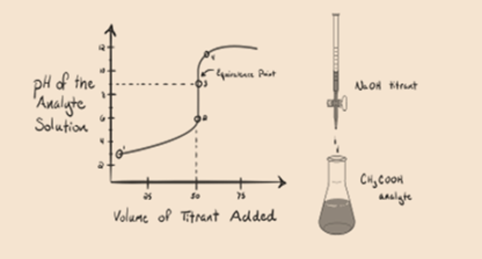
figuur 1.2
figuur 1.2 toont op punt 1 dat NaOH nog niet is toegevoegd, dus op dit moment is de pH van de analyt laag omdat het meestal H3O+ bevat wanneer CH3COOH dissocieert. Maar aangezien azijnzuur een zwak zuur is, zal de pH in eerste instantie hoger zijn.

als we NaOH dropwise blijven toevoegen, zal H3O+ langzaam beginnen te worden geconsumeerd door OH– slowly. Dit zal worden geproduceerd door de dissociatie vannaoh. Maar hier is de analyt nog steeds zuur door de aanwezigheid van H3O + ionen meestal.
Infiguur 1.2 punt 2 geeft de pH aan die is geregistreerd op een moment vlak voordat de aneutralisatie volledig plaatsvindt.
punt 3 is het equivalentiepunt. Dit is het punt waar mol van NaOH gelijk is aan de Mol van CH3COOH in een analyte. Hydroniumionen worden volledig geneutraliseerd door hydroxylionen. De oplossing bevat dan CH3COONa zout en H2O.

opmerking:
u kunt hier een verschil opmerken ten opzichte van een geval 1 waarbij a een sterk zuur heeft getitreerd tegen een sterke base. In dit geval (zwak zuur en een strongbase) is de pH niet neutraal op een equivalentiepunt. De oplossing is een pH~9 op het equivalentiepunt. Laten we uitzoeken de reden hieronder.
uit bovenstaande vergelijking blijkt dat de oplossing CH3COONa bevat op het equivalentiepunt. Dit dissocieert in een natriumion en acetaationen. Acetaation is de geconjugeerde base van het zwakke zuur CH3COOH. Daarom is CH3COO-relatief een sterke base (zwak zuur heeft een sterke geconjugeerde base) daarom reageren ze met water om hydroxideionen te produceren die de pH verhogen tot bijna 9 op het equivalentiepunt.
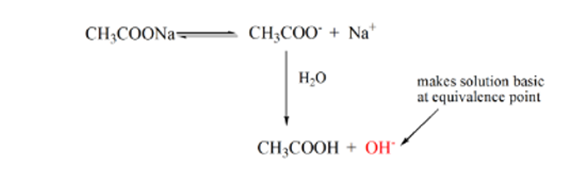
punt 4 in figuur 1.2 laat zien dat wanneer natriumhydroxide in grotere hoeveelheid is, de verkregen titratiecurve identiek zal zijn aan HCl-NaOH.
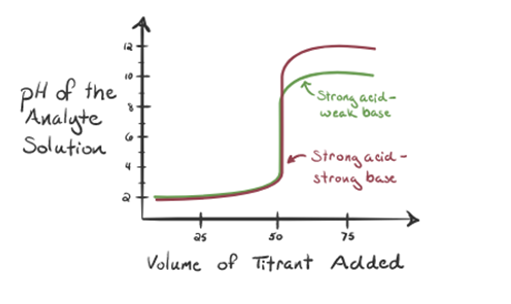
- sterk zuur met een zwakke base:
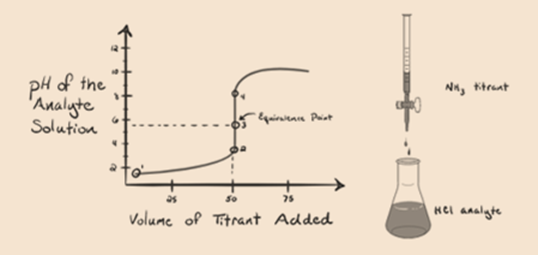
hier beschouwen we zoutzuur als een sterk zuur als analyt en ammoniak als een zwakke base als titrant. Als we een grafiek plotten tussen de pH van de analyte-oplossing en het volume van de titrant NH3, krijgen we een titratiecurve zoals hieronder gegeven:
figuur 1.3
in figuur 1.3 uit punt 1 blijkt dat wanneer geen ammoniak wordt toegevoegd, de pH van de analyt laag zal zijn, aangezien deze voornamelijk H3O+ bevat uit de dissociatie van zoutzuur.
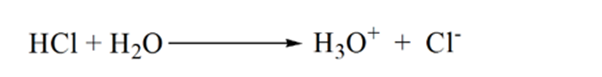
als ammoniak druppelsgewijs wordt toegevoegd, begint H3O + langzaam door ammoniak te worden geconsumeerd. De analyt zal nog steeds zuur zijn als gevolg van de meerderheid van H3O+ ionen.
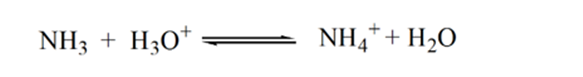
punt 2 in figuur 1.3 geeft aan dat de pH wordt geregistreerd op een punt vlak voordat de aneutralisatie volledig plaatsvindt.
punt 3 toont het equivalentiepunt. Hier is het aantal mol van toegevoegde NH3 gelijk aan de Mol van HCl in de analyte. De hydroniumionen zijn volledig gehydrateerd door NH3.
opmerking:
opgemerkt wordt dat in het geval van de zwakke base tegen een sterk zuur de pH op het equivalentiepunt niet neutraal is. Vandaar dat de oplossing die wordt bereikt zuur zal zijn met een pH rond 5,5 op het punt van gelijkwaardigheid.
de reden hiervoor is dat de oplossing op een equivalentiepunt alleen ammoniumionen NH4+ en chlorideionen, CL-bevat. Aangezien de ammoniumionen het geconjugeerde zuur van een zwakke base zijn, d.w.z. NH3. Daarom is NH4+ een sterk zuur en reageert NH4+ met water om hydroniumionen te produceren waardoor de oplossing zuur wordt.
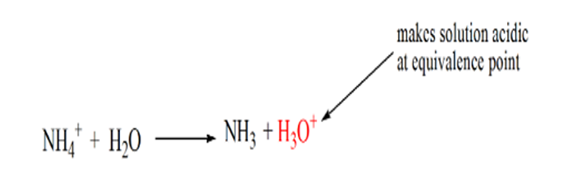
punt 4 laat zien dat we na het bereiken van een equivalentiepunt ammoniak blijven toevoegen en dat bij overschrijding de pH zal beginnen te stijgen. Ammoniak is een zwakke base dus de pH is hoger dan 7 maar het is lager in vergelijking met een sterke base NaOH getoond in geval 1.
- Weakbase met een zwak zuur:
laten we ammoniak overwegen, een zwakke base als analyt en een azijnzuur dat een zwak zuur is als titrant. Als we een grafiek plotten tussen de pH van de analyt-oplossing versus het volume van het azijnzuur als titrant, krijgen we een titratiecurve zoals hieronder:
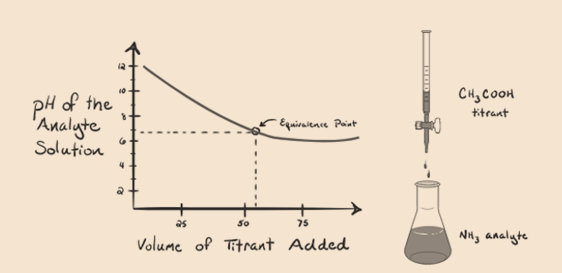
figuur 1.4
we hebben gemerkt dat er geen steil in deze grafiek plot. Dit is wat we noemen een “punt van verbuiging” op het punt van gelijkwaardigheid. De afwezigheid van de vereiste steile verandering in pH geeft ons niet veel informatie door een dergelijke acurve.