„být, nebo nebýt, to je otázka.“I když jsme všichni připraveni na rozhodnutí o životě nebo smrti, tato existenciální dichotomie je pro embryonální buňky výjimečně ostrá. Programovaná buněčná smrt, nazývaná apoptóza,* je normální součástí vývoje. V hlístici C. elegans, ve které můžeme spočítat počet buněk, zemře přesně 131 buněk podle normálního vývojového vzorce. Všechny buňky z této hlístice jsou „naprogramovány“ zemřít, pokud nejsou aktivně řečeno, ani podstoupit apoptózu. U lidí umírá každý den až 1011 buněk u každého dospělého a jsou nahrazeny jinými buňkami. (Hmotnost buněk, které každý rok ztrácíme normální buněčnou smrtí, se blíží celé naší tělesné hmotnosti!) V děloze jsme neustále vytvářeli a ničili buňky a vygenerovali jsme asi třikrát tolik neuronů, kolik jsme nakonec skončili, když jsme se narodili. Lewis Thomas (1992) trefně poznamenal,
než jsem se narodil, Více mě zemřelo, než přežilo. Nebylo divu, že si nevzpomínám; během té doby jsem devět měsíců procházel mozkem za mozkem, konečně vymyslet jeden model, který by mohl být člověk, vybavený pro jazyk.
Apoptóza je nezbytný nejen pro správnou rozteč a orientaci neuronů, ale také pro generování středního ucha prostor, vaginální otvor, a prostory mezi prsty a prsty Saunders a Fallon 1966Roberts a Miller 1998;Rodriguez et al. 1997. Apoptóza prořezává nepotřebné struktury, řídí počet buněk v konkrétních tkáních a vyřezává složité orgány.
různé tkáně používají různé signály pro apoptózu. Jedním ze signálů často používaných u obratlovců je kostní morfogenetický protein 4 (BMP4). Některé tkáně, jako je pojivová tkáň, reagují na BMP4 diferenciací na kost. Jiní, jako je žába gastrula ectoderm, reagují na BMP4 diferenciací na kůži. Ještě jiní, jako jsou buňky neurálních hřebenů a primordie zubů, reagují degradací své DNA a umíráním. Ve vyvíjejícím se zubu, například, četné růstové a diferenciační faktory jsou vylučovány smaltovaným uzlem. Poté, co hrot narostl, smaltovaný uzel syntetizuje BMP4 a vypne se apoptózou (viz kapitola 13; Vaahtokari et al. 1996b).
V jiné tkáně, buňky jsou „naprogramovány“ zemřít, a oni zůstanou naživu pouze tehdy, pokud nějaký růstu nebo diferenciace faktor je přítomen na „záchranu“. K tomu dochází během vývoje savčích červených krvinek. Prekurzory červených krvinek v myších játrech potřebují hormon erytropoetin, aby přežily. Pokud ji nedostanou, podstoupí apoptózu. Receptor erytropoetinu působí cestou JAK-STAT a aktivuje transkripční faktor Stat5. Tímto způsobem může množství přítomného erytropoetinu určit, kolik červených krvinek vstupuje do oběhu.
jedna z cest pro apoptózu byla do značné míry vymezena genetickými studiemi C. elegans. Bylo zjištěno, že proteiny kódované ced-3 a ced-4 geny jsou nezbytné pro apoptózu, ale že v buňkách, které nebyly podstoupit apoptózu, tyto geny byly vypnuty produkt ced-9 genu (Obrázek 6.27; Hengartner et al. 1992). Protein CED-4 je faktor aktivující proteázu, který aktivuje CED-3, proteázu, která iniciuje destrukci buňky. Mutace, které inaktivují protein CED-9, způsobují četné buňky, které by normálně přežily, aby aktivovaly své geny ced-3 a ced-4 a zemřely. To vede ke smrti celého embrya. Naopak mutace CED-9 způsobují tvorbu proteinu CED-9 v buňkách, které by jinak zemřely. Gen ced-9 se tedy jeví jako binární přepínač, který reguluje volbu mezi životem a smrtí na buněčné úrovni. Je možné, že každá buňka v embryu hlístice je připravena zemřít a ty buňky, které přežijí, jsou zachráněny aktivací genu ced-9.
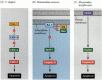
obrázek 6.27
dráhy apoptózy u hlístic a savců. (A) v C.elegans je protein CED-4 aktivační faktor proteázy, který může aktivovat proteázu CED-3. Proteáza CED-3 iniciuje události destrukce buněk. CED-9 může inhibovat CED-4 (a CED-9 může být (více…)
proteiny CED-3 a CED-4 tvoří centrum dráhy apoptózy, která je společná všem studovaným zvířatům. Spouštěčem apoptózy může být vývojová narážka, jako je konkrétní molekula (jako je BMP4 nebo glukokortikoidy) nebo ztráta adheze k matrici. Buď typ cue může aktivovat proteiny CED-3 nebo CED-4 nebo inaktivovat molekuly CED-9. U savců jsou homologové proteinu CED-9 členy rodiny genů Bcl-2. Tato rodina zahrnuje Bcl-2,Bcl-X a podobné geny. Funkční podobnosti jsou tak silné, že pokud je aktivní lidský gen BCL-2 umístěn do embryí C. elegans, zabraňuje normálně se vyskytujícím buněčným úmrtím v embryích hlístic (Vaux et al . 1992). Ve vývoji červených krvinek obratlovců (zmíněno výše)funguje transkripční faktor Stat5 aktivovaný erytropoetinem vazbou na promotor genu Bcl-X, kde aktivuje syntézu tohoto proteinu proti apoptóze (Socolovsky et al . 1999).
savčí homolog z CED-4 je nazýván Apaf-1 (apoptotických proteázy aktivující faktor-1), a podílí se na cytochrom c-závislé aktivace savců CED-3 homology, proteázy kaspázy-9 a kaspázy-3 (Shaham a Horvitz 1996; Cecconi et al. 1998; Jošida a kol. 1998). Aktivace kaspáz způsobuje autodigestaci buňky. Kaspázy jsou silné proteázy a tráví buňku zevnitř. Buněčné proteiny jsou štěpeny a DNA je fragmentována.†
Zatímco apoptóza-nedostatečné hlístice nedostatečné pro CED-4 jsou životaschopné (i přes jejich s 15% více buněk, než wild-type červy), myši s loss-of-function mutace buď pro kaspázy-3 a kaspázy-9 zemřít po narození z masivní přerůstání buněk v nervovém systému (Obrázek 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Myši homozygotní pro cílené odstranění Apaf-1 mají závažné kraniofaciální abnormality,přerůstání mozku a popruh mezi prsty.
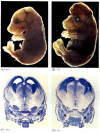
obrázek 6.28
narušení normálního vývoje mozku blokováním apoptózy. U myší, u kterých byla kaspáza-9 nebo Apaf-1 vyřazena, nedochází k normální neurální apoptóze. U myší s deficitem kaspázy 9 je nadměrná proliferace mozkových neuronů zřejmá na morfologickém (více…)
u savců existuje více než jedna cesta k apoptóze. Na apoptózy lymfocytů, například, není ovlivněna smazání Apaf-1 nebo kaspázy-9, a podporuje samostatnou dráhu zahájil CD95 (Obrázek 6.27B, C)různé kaspázy mohou fungovat v různých typech buněk pro zprostředkování apoptotických signálů (Hakem et al . 1998; Kuida a kol. 1998).
webové stránky
6.7 použití apoptózy. Apoptóza se používá pro řadu procesů v průběhu vývoje. Tato webová stránka zkoumá roli apoptózy v takových jevech, jako je vývoj zárodečných buněk Drosophila a oči slepých jeskynních ryb. http://www.devbio.com/chap06/link0607.shtml
Box
interakce buňka-buňka a šance při určování typů buněk.
Poznámky pod čarou
*
Apoptóza („p“jsou vyslovována) pochází z řeckého slova pro přírodní procesy listí padající ze stromů nebo okvětní lístky z květin. Je aktivní a může být evolučně vybrán. Druhý typ buněčné smrti, nekróza, je patologická smrt způsobená vnějšími faktory, jako je zánět nebo toxické poškození.
†
existují určité důkazy (viz Barinaga 1998a, b; Saudou et al. 1998), že aktivace dráhy apoptózy u dospělých neuronů může být zodpovědná za patologii Alzheimerovy choroby a mrtvice. Fragmentace DNA je jedním z hlavních způsobů, jak je apoptóza rozpoznána, a je vidět v oblastech mozku postižených těmito nemocemi. Jeho fragmentace na kousky specifické velikosti (chráněné a držené pohromadě nukleosomy) může být způsobena trávením Poly (ADP-ribózy) polymerázy (PARP) kaspázou-3 (Lazebnik et al. 1994). PARP rozpoznává a opravuje zlomy DNA. Další informace o dalších cestách vedoucích k apoptóze viz Zelená 1998.