“at være eller ikke være: det er spørgsmålet.”Mens vi alle er klar til beslutninger om liv eller død, er denne eksistentielle dikotomi usædvanligt skarp for embryonale celler. Programmeret celledød, kaldet apoptose,* er en normal del af udviklingen. I nematoden C. elegans, hvor vi kan tælle antallet af celler, dør nøjagtigt 131 celler i henhold til det normale udviklingsmønster. Alle cellerne i denne nematode er” programmeret ” til at dø, medmindre de aktivt bliver bedt om ikke at gennemgå apoptose. Hos mennesker dør så mange som 1011 celler i hver voksen hver dag og erstattes af andre celler. (Faktisk er massen af celler, vi mister hvert år gennem normal celledød, tæt på hele vores kropsvægt!) I livmoderen lavede og ødelagde vi konstant celler, og vi genererede omkring tre gange så mange neuroner, som vi til sidst endte med, da vi blev født. Thomas Jørgensen (1992),
da jeg blev født, var flere af mig døde end overlevet. Det var ikke underligt, at jeg ikke kan huske; i løbet af den tid gik jeg gennem hjerne efter hjerne i ni måneder og endelig konstruerede den ene model, der kunne være menneskelig, udstyret til sprog.
apoptose er ikke kun nødvendig for den korrekte afstand og orientering af neuroner, men også for at generere mellemøret, vaginalåbningen og mellemrummet mellem vores fingre og tæer Saunders og Fallon 1966roberts og Miller 1998;Rodrigues et al. 1997. Apoptose svesker væk unødvendige strukturer, styrer antallet af celler i især væv og sculpts komplekse organer.
forskellige væv bruger forskellige signaler til apoptose. Et af de signaler, der ofte anvendes i hvirveldyr, er knoglemorfogenetisk protein 4 (BMP4). Nogle væv, såsom bindevæv, reagerer på BMP4 ved at differentiere sig til knogler. Andre, såsom frøen gastrula ectoderm, reagerer på BMP4 ved at differentiere sig i huden. Atter andre, såsom neurale kamceller og tandprimordier, reagerer ved at nedbryde deres DNA og dø. I den udviklende tand udskilles for eksempel adskillige vækst-og differentieringsfaktorer af emaljeknuden. Efter at cusp er vokset, syntetiserer emaljeknuden BMP4 og lukker sig ned ved apoptose (se Kapitel 13; Vaahtokari et al. 1996b).
i andre væv er cellerne “programmeret” til at dø, og de vil kun forblive i live, hvis der er en vækst-eller differentieringsfaktor til stede for at “redde” dem. Dette sker under udviklingen af pattedyrs røde blodlegemer. De røde blodlegemer i muselever har brug for hormonet erythropoietin for at overleve. Hvis de ikke modtager det, gennemgår de apoptose. Erythropoietin-receptoren virker gennem jak-STAT-vejen og aktiverer Stat5-transkriptionsfaktoren. På denne måde kan mængden af tilstedeværende erythropoietin bestemme, hvor mange røde blodlegemer der kommer ind i kredsløbet.
en af veje til apoptose blev stort set afgrænset gennem genetiske undersøgelser af C. elegans. Det blev fundet, at proteinerne kodet af CED-3-og ced-4-generne var essentielle for apoptose, men at i cellerne, der ikke gennemgik apoptose, blev disse gener slukket af produktet af ced-9-genet (figur 6.27 a; Hengartner et al. 1992). CED-4-proteinet er en proteaseaktiverende faktor, der aktiverer CED-3, en protease, der initierer ødelæggelsen af cellen. Mutationer, der inaktiverer CED-9-proteinet, forårsager adskillige celler, der normalt ville overleve for at aktivere deres CED-3 og ced-4 gener og dø. Dette fører til døden af hele embryoet. Omvendt får gain-of-function mutationer af ced-9 CED-9 protein til at blive lavet i celler, der ellers ville dø. Ced – 9-genet ser således ud til at være en binær omskifter, der regulerer valget mellem liv og død på cellulært niveau. Det er muligt, at hver celle i nematodeembryoet er klar til at dø, og de celler, der overlever, reddes ved aktivering af ced-9-genet.
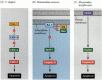
figur 6.27
apoptoseveje hos nematoder og pattedyr. (A) i C. elegans er CED-4-proteinet en proteaseaktiverende faktor, der kan aktivere CED-3-proteasen. CED – 3-protease initierer celleødelæggelseshændelserne. CED-9 kan hæmme CED-4 (og CED-9 kan være (mere…)
CED-3-og CED-4-proteinerne danner midten af apoptosevejen, der er fælles for alle undersøgte dyr. Udløseren til apoptose kan være et udviklingsmæssigt signal, såsom et bestemt molekyle (såsom BMP4 eller glukokortikoider) eller tab af vedhæftning til en matrice. Enten type cue kan aktivere CED-3 eller CED-4 proteiner eller inaktivere CED-9 molekyler. Hos pattedyr er homologerne af CED-9-proteinet medlemmer af Bcl-2-familien af gener. Denne familie omfatter Bcl-2, Bcl-H og lignende gener. De funktionelle ligheder er så stærke, at hvis et aktivt humant BCL-2-gen placeres i C. elegans-embryoner, forhindrer det normalt forekommende celledødsfald i nematodeembryoerne. 1992). Ved udvikling af hvirveldyr af røde blodlegemer (nævnt ovenfor) fungerer STAT5-transkriptionsfaktoren aktiveret af erythropoietin ved at binde til promotoren af Bcl-genet, hvor det aktiverer syntesen af det anti-apoptoseprotein (Socolovsky et al. 1999).
pattedyrets homolog af CED-4 kaldes Apaf-1 (apoptotisk proteaseaktiverende faktor-1), og den deltager i cytokrom C-afhængig aktivering af pattedyrets CED-3-homologer, proteaserne caspase-9 og caspase-3 (Shaham og Horvitse 1996; Cecconi et al. 1998; Yoshida et al. 1998). Aktiveringen af caspaserne forårsager autodigestionen af cellen. Caspaser er stærke proteaser, og de fordøjer cellen indefra. De cellulære proteiner spaltes, og DNA ‘ et er fragmenteret.Mens apoptose-mangelfulde nematoder, der er mangelfulde for CED-4, er levedygtige (på trods af at de har 15% flere celler end vilde orme), dør mus med tab af funktionsmutationer for enten caspase-3 eller caspase-9 omkring fødslen fra massiv celleovervækst i nervesystemet (figur 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Mus, der er homogene til målrettede sletninger af Apaf-1, har alvorlige kraniofaciale abnormiteter, hjernevækst og bånd mellem tæerne.
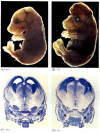
figur 6.28
forstyrrelse af normal hjerneudvikling ved at blokere apoptose. Hos mus, hvor caspase-9 eller Apaf-1 er blevet slået ud, forekommer normal neural apoptose ikke. I caspase 9-mangelfulde mus er overproliferationen af hjerneneuroner åbenbar på en morfologisk (mere…)
hos pattedyr er der mere end en vej til apoptose. Apoptosen af lymfocytterne påvirkes for eksempel ikke af deletionen af Apaf-1 eller caspase-9 og fungerer ved en separat vej initieret af CD95-proteinet (figur 6.27B, C) forskellige caspaser kan fungere i forskellige celletyper for at formidle de apoptotiske signaler (Hakem et al. 1998; Kuida et al. 1998).
hjemmeside
6.7 anvendelser af apoptose. Apoptose bruges til adskillige processer gennem hele udviklingen. Denne hjemmeside udforsker apoptosens rolle i sådanne fænomener som Drosophila kimcelleudvikling og øjnene af blinde hulefisk. http://www.devbio.com/chap06/link0607.shtml
boks
Celle-Celle interaktioner og Chance i bestemmelsen af celletyper.
fodnoter
*
apoptose (begge”p” S udtales) kommer fra det græske ord for de naturlige processer af blade, der falder fra træer eller kronblade fra blomster. Det er aktivt og kan vælges evolutionært. Den anden type celledød, nekrose, er en patologisk død forårsaget af eksterne faktorer såsom betændelse eller toksisk skade.
†
der er nogle beviser (se Barinaga 1998a,b; Saudou et al. 1998) at aktivering af apoptosevejen i voksne neuroner kan være ansvarlig for patologien for sygdom og slagtilfælde. Fragmentering af DNA er en af de vigtigste måder, hvorpå apoptose genkendes, og det ses i regioner i hjernen, der er ramt af disse sygdomme. Dens fragmentering i specifikke størrelser (beskyttet og holdt sammen af nukleosomer) kan være forårsaget af fordøjelsen af Poly(ADP-ribose) polymerase (PARP) af caspase-3 (Lasebnik et al. 1994). PARP genkender og reparerer DNA-pauser. For mere om andre veje, der fører til apoptose, se Grøn 1998.