« Être, ou ne pas être: telle est la question. »Alors que nous sommes tous prêts à prendre des décisions de vie ou de mort, cette dichotomie existentielle est exceptionnellement frappante pour les cellules embryonnaires. La mort cellulaire programmée, appelée apoptose*, est une partie normale du développement. Chez le nématode C. elegans, dans lequel nous pouvons compter le nombre de cellules, exactement 131 cellules meurent selon le schéma de développement normal. Toutes les cellules de ce nématode sont « programmées » pour mourir à moins qu’on ne leur dise activement de ne pas subir d’apoptose. Chez l’homme, jusqu’à 1011 cellules meurent chaque jour chez chaque adulte et sont remplacées par d’autres cellules. (En effet, la masse de cellules que nous perdons chaque année par la mort cellulaire normale est proche de tout notre poids corporel!) Dans l’utérus, nous fabriquions et détruisions constamment des cellules, et nous avons généré environ trois fois plus de neurones que ce que nous avons finalement obtenu à notre naissance. Lewis Thomas (1992) a bien noté,
Au moment de ma naissance, plus d’entre moi étaient morts qu’ils n’avaient survécu. Ce n’était pas étonnant que je ne m’en souvienne pas; pendant ce temps, j’ai traversé cerveau après cerveau pendant neuf mois, pour finalement concevoir le seul modèle qui pourrait être humain, équipé pour le langage.
L’apoptose est nécessaire non seulement pour l’espacement et l’orientation appropriés des neurones, mais aussi pour générer l’espace de l’oreille moyenne, l’ouverture vaginale et les espaces entre nos doigts et nos orteils Saunders et Fallon 1966Roberts et Miller 1998; Rodriguez et al. 1997. L’apoptose élimine les structures inutiles, contrôle le nombre de cellules dans des tissus particuliers et sculpte des organes complexes.
Différents tissus utilisent différents signaux pour l’apoptose. L’un des signaux souvent utilisés chez les vertébrés est la protéine morphogénétique osseuse 4 (BMP4). Certains tissus, tels que le tissu conjonctif, répondent à la BMP4 en se différenciant en os. D’autres, comme l’ectoderme de la gastrule de la grenouille, répondent à la BMP4 en se différenciant en peau. D’autres encore, comme les cellules de la crête neurale et les primordiums dentaires, réagissent en dégradant leur ADN et en mourant. Dans la dent en développement, par exemple, de nombreux facteurs de croissance et de différenciation sont sécrétés par le nœud d’émail. Une fois la cuspide développée, le nœud d’émail synthétise BMP4 et se ferme par apoptose (voir chapitre 13; Vaahtokari et al. 1996b).
Dans d’autres tissus, les cellules sont « programmées » pour mourir, et elles ne resteront vivantes que si un facteur de croissance ou de différenciation est présent pour les « sauver ». Cela se produit lors du développement des globules rouges de mammifères. Les précurseurs des globules rouges dans le foie de la souris ont besoin de l’hormone érythropoïétine pour survivre. S’ils ne le reçoivent pas, ils subissent une apoptose. Le récepteur de l’érythropoïétine fonctionne par la voie JAK-STAT, activant le facteur de transcription Stat5. De cette façon, la quantité d’érythropoïétine présente peut déterminer le nombre de globules rouges entrant dans la circulation.
L’une des voies d’apoptose a été largement délimitée par des études génétiques sur C. elegans. Il a été constaté que les protéines codées par les gènes ced-3 et ced-4 étaient essentielles à l’apoptose, mais que dans les cellules qui ne subissaient pas d’apoptose, ces gènes étaient désactivés par le produit du gène ced-9 (Figure 6.27A; Hengartner et al. 1992). La protéine CED-4 est un facteur d’activation de la protéase qui active la CED-3, une protéase qui déclenche la destruction de la cellule. Les mutations qui inactivent la protéine CED-9 provoquent la mort de nombreuses cellules qui survivraient normalement pour activer leurs gènes ced-3 et ced-4. Cela conduit à la mort de l’embryon entier. Inversement, des mutations de gain de fonction de ced-9 provoquent la fabrication de la protéine CED-9 dans des cellules qui mourraient autrement. Ainsi, le gène ced-9 semble être un commutateur binaire qui régule le choix entre la vie et la mort au niveau cellulaire. Il est possible que chaque cellule de l’embryon de nématode soit prête à mourir et que les cellules qui survivent soient sauvées par l’activation du gène ced-9.
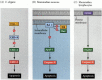
Figure 6.27
Voies d’apoptose chez les nématodes et les mammifères. (A) Chez C. elegans, la protéine CED-4 est un facteur d’activation de la protéase qui peut activer la protéase CED-3. La protéase CED-3 déclenche les événements de destruction cellulaire. CED-9 peut inhiber CED-4 (et CED-9 peut l’être (plus…)
Les protéines CED-3 et CED-4 forment le centre de la voie d’apoptose commune à tous les animaux étudiés. Le déclencheur de l’apoptose peut être un signal de développement tel qu’une molécule particulière (telle que BMP4 ou glucocorticoïdes) ou la perte d’adhésion à une matrice. L’un ou l’autre type de repère peut activer les protéines CED-3 ou CED-4 ou inactiver les molécules CED-9. Chez les mammifères, les homologues de la protéine CED-9 font partie de la famille de gènes Bcl-2. Cette famille comprend des gènes Bcl-2, Bcl-X et similaires. Les similitudes fonctionnelles sont si fortes que si un gène BCL-2 humain actif est placé dans les embryons de C. elegans, il empêche la mort cellulaire normale des embryons de nématodes (Vaux et al. 1992). Dans le développement des globules rouges vertébrés (mentionné ci-dessus), le facteur de transcription Stat5 activé par l’érythropoïétine fonctionne en se liant au promoteur du gène Bcl-X, où il active la synthèse de cette protéine anti-apoptose (Socolovsky et al. 1999).
L’homologue mammalien du CED-4 est appelé Apaf-1 (facteur d’activation de la protéase apoptotique-1), et il participe à l’activation dépendante du cytochrome c des homologues mammaliens du CED-3, les protéases caspase-9 et caspase-3 (Shaham et Horvitz 1996; Cecconi et al. 1998; Yoshida et coll. 1998). L’activation des caspases provoque l’autodigestion de la cellule. Les caspases sont des protéases fortes et elles digèrent la cellule de l’intérieur. Les protéines cellulaires sont clivées et l’ADN est fragmenté.†
Alors que les nématodes déficients en apoptose et déficients en DEC-4 sont viables (bien qu’ils aient 15% plus de cellules que les vers de type sauvage), les souris avec des mutations de perte de fonction pour la caspase-3 ou la caspase-9 meurent vers la naissance à cause d’une prolifération cellulaire massive dans le système nerveux (figure 6.28; Kuida et al. 1996, 1998; Jacobson et coll. 1997). Les souris homozygotes pour des délétions ciblées d’Apaf-1 présentent de graves anomalies craniofaciales, une prolifération cérébrale et des sangles entre les orteils.
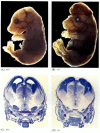
Figure 6.28
Perturbation du développement normal du cerveau en bloquant l’apoptose. Chez les souris chez lesquelles la caspase-9 ou l’Apaf-1 a été éliminée, l’apoptose neurale normale ne se produit pas. Chez les souris déficientes en caspase 9, la surprolifération des neurones cérébraux est évidente sur un plan morphologique (plus…)
Chez les mammifères, il existe plus d’une voie d’apoptose. L’apoptose des lymphocytes, par exemple, n’est pas affectée par la délétion de l’Apaf-1 ou de la caspase-9, et fonctionne par une voie distincte initiée par la protéine CD95 (Figure 6.27B, C) Différentes caspases peuvent fonctionner dans différents types cellulaires pour médier les signaux apoptotiques (Hakem et al. 1998; Kuida et coll. 1998).
SITE WEB
6.7 Les utilisations de l’apoptose. L’apoptose est utilisée pour de nombreux processus tout au long du développement. Ce site Web explore le rôle de l’apoptose dans des phénomènes tels que le développement des cellules germinales de la Drosophile et les yeux des poissons des cavernes aveugles. http://www.devbio.com/chap06/link0607.shtml
Boîte
Interactions Cellule-Cellule et Hasard dans la Détermination des Types de Cellules.
Notes de Bas de Page
*
L’apoptose (les deux « p » sont prononcés) vient du mot grec pour les processus naturels des feuilles tombant des arbres ou des pétales des fleurs. Il est actif et peut être sélectionné de manière évolutive. L’autre type de mort cellulaire, la nécrose, est une mort pathologique causée par des facteurs externes tels qu’une inflammation ou une lésion toxique.
†
Il existe certaines preuves (voir Barinaga 1998a, b; Saudou et al. 1998) que l’activation de la voie de l’apoptose dans les neurones adultes peut être responsable de la pathologie de la maladie d’Alzheimer et des accidents vasculaires cérébraux. La fragmentation de l’ADN est l’un des principaux moyens de reconnaître l’apoptose, et elle est observée dans les régions du cerveau touchées par ces maladies. Sa fragmentation en morceaux de taille spécifique (protégés et maintenus ensemble par des nucléosomes) peut être causée par la digestion de la poly (ADP-ribose) polymérase (PARP) par la caspase-3 (Lazebnik et al. 1994). PARP reconnaît et répare les ruptures d’ADN. Pour en savoir plus sur les autres voies menant à l’apoptose, voir Green 1998.