촉매 변환기
촉매 변환기는 일산화탄소와 같은 독성 분자와 자동차 배기 가스의 다양한 질소 산화물을 이산화탄소와 질소와 같은 더 무해한 분자로 변화시킵니다. 그들은 백금,팔라듐 및 로듐과 같은 값 비싼 금속을 이종 촉매로 사용합니다.
금속은 세라믹 벌집 위에 얇은 층으로 증착됩니다. 이것은 표면을 확대하고 최소한에 사용된 금속 양을 지킵니다.
전형적인 일산화탄소와 일산화 질소 사이의 반응을 취함:
![]()
![]()
촉매 변환기는 촉매 중독의 영향을받을 수 있습니다. 이것은 반응의 일부가 아닌 무언가가 촉매의 표면에 매우 강하게 흡착되어 정상적인 반응물이 도달하는 것을 방지 할 때 발생합니다.
납은 촉매 컨버터를 위한 친밀한 촉매 독입니다. 그것은 비싼 금속의 벌집을 입히고 작동을 멈 춥니 다.
과거에는 납 화합물을 가솔린(가솔린)에 첨가하여 엔진에서 더 부드럽게 연소시킵니다. 그러나 납이 함유 된 연료를 사용하는 경우 촉매 변환기를 사용할 수 없습니다. 그래서 촉매 변환기는 일산화탄소와 질소 산화물과 같은 유독 가스를 제거하는 데 도움이되었을뿐만 아니라 가솔린에서 유독 한 납 화합물을 제거하도록 강요했습니다.
사용의 바나듐(V)에 산화 접촉 과정
동안 프로세스의 제조를 위한 황산,황산으로 변환할 수있 유황 삼산화. 이것은 이산화황 과 산소 위에 고체 바나듐(브이)산화물 촉매.
![]()
![]()
이 예는 가스가 실제로 촉매의 표면과 반응하여 일시적으로 변화하기 때문에 이전 예와 약간 다릅니다. 그들의 산화 국가를 바꾸는 그들의 기능 때문에 촉매로 작동하는 전이 금속 및 그들의 화합물의 능력의 좋은 보기 입니다.
이산화황은 바나듐에 의해 삼산화황으로 산화된다. 이 공정에서 바나듐 산화물은 바나듐(4)산화물로 환원된다.
![]()
![]()
바나듐(4)산화물은 산소에 의해 다시 산화된다.
![]()
![]()
이것은 촉매가 반응 과정에서 변화될 수 있는 방법의 좋은 예이다. 반응이 끝나면 화학적으로 시작된 것과 동일합니다.
균질 촉매 작용
이것은 반응물과 동일한 상에서 촉매를 갖는다. 일반적으로 모든 것이 가스로 존재하거나 단일 액체 단계에 포함됩니다. 예제에는 이러한 각 중 하나가 포함되어 있습니다. . .
균질 촉매의 예
퍼설페이트 이온과 요오드화물 이온 사이의 반응
이것은 촉매의 맥락에서만 만날 수 있는 용액 반응이지만 사랑스러운 예이다!과 황산염 이온(퍼 옥소 디 황산염 이온)은 매우 강력한 산화제입니다. 요오드화물 이온은 요오드로 매우 쉽게 산화된다. 그리고 물 속의 용액에서 그들 사이의 반응은 매우 느립니다.
당신이 방정식을 보면,그 이유를 쉽게 알 수있다:
![]()
![]()
반응은 2 개의 부정적인 이온 사이 충돌을 필요로 합니다. 반발은 그 방법으로 심각하게 얻을 것입니다!
촉매 반응은 그 문제를 완전히 피한다. 촉매는 동일한 용액에 첨가되는 철(2)또는 철(3)이온 일 수있다. 이것은 산화 상태를 변화시키는 그들의 능력 때문에 촉매로서 전이 금속 화합물의 사용의 또 다른 좋은 예이다.
논증을 위해,우리는 촉매를 철(2)이온으로 취할 것이다. 당신이 곧 볼 수 있듯이,당신이 철(2)또는 철(3)이온을 사용하는지 여부는 실제로 중요하지 않습니다.
과황산염 이온은 철(2)이온을 철(3)이온으로 산화시킨다. 이 과정에서과 황산염 이온은 황산 이온으로 환원됩니다.
![]()
![]()
철(3)이온은 요오드화 이온을 요오드로 산화시키기에 충분히 강하다. 이 과정에서 그들은 철(2)이온으로 다시 환원됩니다.
![]()
![]()
전반적인 반응에서 이러한 개별 단계 모두 긍정적이 고 부정적인 이온 사이의 충돌을 포함 한다. 이것은 촉매 반응에서 두 개의 음이온 사이의 충돌보다 성공적 일 가능성이 훨씬 더 높습니다.
철(2)이온 대신 철(3)이온을 촉매로 사용하면 어떻게 됩니까? 반응은 단순히 다른 순서로 발생합니다.
대기 오존의 파괴
이것은 모든 것이 가스로 존재하는 균질 촉매 작용의 좋은 예입니다.
오존은 자외선의 작용으로 고 대기에서 끊임없이 형성되고 다시 분해된다. 일반 산소 분자는 자외선을 흡수하여 개별 산소 원자로 분해됩니다. 이들은 쌍을 이루지 않은 전자를 가지고 있으며 자유 라디칼로 알려져 있습니다. 그들은 매우 반응 적입니다.
![]()

산소 라디칼은 일반 산소 분자와 결합하여 오존을 만들 수 있습니다.
![]()
![]()
오존은 또한 자외선을 흡수하여 일반 산소와 산소 라디칼로 다시 분할 될 수 있습니다.
![]()
![]()
오존의 이 대형 그리고 끊는 것은 항상 일어나고 있다. 함께 찍은,이 반응은 지구 표면에 도달하기 위해 대기를 관통하는 많은 유해한 자외선을 막습니다.
우리가 관심있는 촉매 반응은 오존을 파괴하여 이러한 방식으로 자외선을 흡수하는 것을 멈 춥니 다.예를 들어,클로로플루오로카본은 에어로졸 및 냉매로서 광범위하게 사용되었다. 대기 중에서의 느린 분해는 염소 원자-염소 자유 라디칼을 생성합니다. 이들은 오존의 파괴를 촉매합니다.
이것은 두 단계로 발생합니다. 첫번째에서는,오존은 부서지고 새로운 유리기 생성합니다.
![]()
![]()
염소 라디칼 촉매는 제 2 반응에 의해 재생된다. 이것은 클로 라디칼이 오존 분자 또는 산소 라디칼에 맞는지 여부에 따라 두 가지 방법으로 발생할 수 있습니다.
산소 라디칼에 닿으면(이전에 살펴본 반응 중 하나에서 생성됨):
![]()
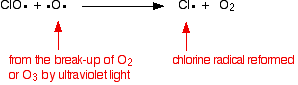
또는 그것이 오존 분자를 명중하는 경우에:
![]()
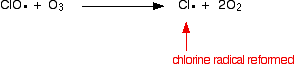
염소 라디칼이 계속 재생되기 때문에 각각 수천 개의 오존 분자를 파괴 할 수 있습니다.
자가 촉매
자가 촉매
자가 촉매
자가 촉매
망간산 이온에 의한 에탄이오산의 산화
자가 촉매 반응에서 반응은 그 생성물 중 하나에 의해 촉매된다. 이것의 가장 간단한 예 중 하나는 망간 산 칼륨(7 세)(과망간산 칼륨)의 산성화 된 용액에 의한 에탄 디오 산 용액(옥살산)의 산화에 있습니다.
![]()
![]()
반응은 실내 온도에 아주 느립니다. 그것은 칼륨 망가 네이트(7)용액의 농도를 찾기 위해 적정으로 사용되며 일반적으로 약 60 의 온도에서 수행됩니다.
반응은 망간(2)이온에 의해 촉매된다. 반응이 시작되기 전에 존재하는 것들은 분명히 없으며,그래서 그것은 실온에서 매우 천천히 시작됩니다. 그러나,방정식을 보면,제품 사이 망간(2)이온을 찾을 수 있습니다. 반응이 진행됨에 따라 점점 더 많은 촉매가 생성되어 반응 속도가 빨라집니다.
시간이 지남에 따라 반응물 중 하나의 농도를 플로팅하여 이 효과를 측정할 수 있습니다. 당신은 반응에 대한 정상적인 속도 곡선과는 매우 다른 그래프를 얻습니다.
대부분의 반응은 다음과 같은 속도 곡선을 제공합니다:
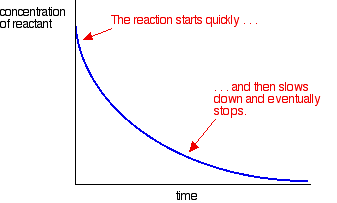
농도는 처음에 높고 그래서 반응은 반응물 농도에 있는 급속한 가을에 의해 빠르 보입니다. 것 들 사용,반응 감속 하 고 결국 반응물 중 하나 이상이 완전히 사용 됩니다 중지.
자동 촉매의 예는 다음과 같은 곡선을 제공합니다:
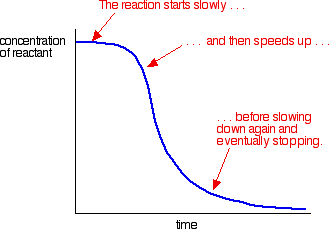
처음에는 느린(촉매되지 않은)반응을 볼 수 있습니다. 촉매가 혼합물에서 형성되기 시작함에 따라,반응 속도가 빨라지고,점점 더 많은 촉매가 형성됨에 따라 점점 더 빨라진다. 결국,물론,속도 떨어지는 것 들 사용 얻을 다시.
경고!
이렇게 보이는 속도 곡선이 반드시 자동 촉매의 예를 보여준다고 가정하지 마십시오. 비슷한 그래프를 생성 할 수있는 다른 효과가 있습니다.
예를 들어,반응이 액체와 반응하는 고체와 관련된 경우,예상되는 반응이 일어나기 전에 액체가 침투해야하는 고체에 일종의 표면 코팅이있을 수 있습니다.
더 일반적인 가능성은 강한 발열 반응이 있고 온도를 제대로 제어하지 못한다는 것입니다. 반응 중에 진화 된 열은 반응 속도를 높입니다.