US Pharm. 2016; 41(4): HS15-HS20.
Sammendrag: Invasiv aspergillose (IA) er en sjelden, alvorlig soppinfeksjon som vanligvis påvirker immunkompromitterte pasienter. Den nøyaktige forekomsten av IA er ikke dokumentert, og rapporterte insidensrater varierer mye. Noen typiske risikofaktorer for IA inkluderer hematopoietiske stamcelletransplantasjoner, langvarig kortikosteroidbehandling, hematologiske maligniteter og HIV. Lungene er det hyppigste STEDET FOR IA; følgelig er symptomer og kliniske manifestasjoner typisk pulmonale. På grunn av den høye risikoen for dødsfall, MÅ IA-ledelsen med de aktuelle agenter starte så raskt som mulig. Vorikonazol er den første linjen empirisk terapi anbefalt Av Infectious Diseases Society Of America retningslinjer; hvis det ikke er klinisk respons, bør berging terapi med andre azoler, echinocandiner eller amfotericin b lipidformuleringer administreres.
Aspergillose Er en soppinfeksjon forårsaket Av Aspergillus, som består av en stor gruppe allestedsnærværende muggsopparter (spp) som oftest finnes i nedbrytende vegetasjon.1 Aspergillose, som oftest observeres hos immunkompromitterte personer, er en signifikant årsak til sykelighet og dødelighet i denne populasjonen, med dødelighet så høyt som 90%.2,3 Det Finnes Flere typer aspergilloseinfeksjoner, inkludert allergisk bronkopulmonal aspergillose, allergisk Aspergillus sinusitt, aspergillom, kronisk lungespergillose, kutan aspergillose og invasiv aspergillose (ia). De fleste av disse infeksjonene er forårsaket Av Aspergillus fumigatus, etterfulgt Av Aspergillus flavus, Aspergillus niger og Aspergillus terreus.4-6 IA er spesielt en av de alvorligste aspergilloseinfeksjonene, og den har en høy dødelighet.5
Etiologi Og Epidemiologi
Vanlige risikofaktorer for IA inkluderer hematopoietisk stamcelletransplantasjon (HSCT), langvarig og alvorlig nøytropeni, hematologiske maligniteter, langvarig kortikosteroidbehandling og HIV. Imidlertid har visse ICU-immunokompetente populasjoner, som pasienter med kronisk obstruktiv lungesykdom, alvorlig leversykdom eller kritiske sykdommer som midlertidig forstyrrer immunsystemet, også økt risiko for IA.5 insidensen AV IA i en typisk INTENSIVAVDELING er rapportert å være 0,33% til 6,9%, som er sammenlignbar med insidensen hos organtransplanterte pasienter.4,5
Aspergillose Er ikke en rapporterbar infeksjon i Usa fordi Det er uvanlig og ikke ansett som en alvorlig trussel mot folkehelsen.6 som et resultat er den eksakte forekomsten AV IA ikke dokumentert. I tillegg kan rapporterte insidensrater variere betydelig, noe som tyder på at geografi kan spille en rolle.4 blant transplantasjonsmottakere varierer forekomsten av IA, med vanlige underliggende tilstander inkludert lymfom og leukemi.7 blant mottakere av organtransplantasjon er forekomsten av IA høyere hos lunge – og levertransplanterte (henholdsvis 2,4% -6% og 1% -8%) enn hos nyre-og hjertetransplanterte (henholdsvis 0,1% -4% og 0,3% -6%).4 forekomsten AV IA hos hsct-mottakere er enda høyere. Allogene HSCT-mottakere har EN IA-forekomst på 2,3% til 11%, som er mer enn det dobbelte av den observerte insidensraten hos autologe hsct-mottakere (0,5% -4%).4 den totale dødsulykkesraten er beregnet til å være 58%.7,8 imidlertid varierer antall dødsfall i IA avhengig av underliggende tilstand. I en systematisk oversikt over 53 studier fra 1995 til 1999 var casedødeligheten hos IA-pasienter høyest hos pasienter med benmargstransplantasjon (86,7%) eller HIV/AIDS (85,7%) og lavest hos pasienter med leukemi eller lymfom (49,3%).7
Patogenese
etter inhalasjon av en fumigatus conidia (luftbårne sporer) utløser respiratoriske epitelceller og alveolære makrofager medfødte immunresponser mot inhalert Aspergillus conidia. Disse patogenene gjenkjenner deretter reseptorer på vertsceller, som beta-glukanreseptoren Dectin-1. Samspillet mellom patogener og reseptorer fremkaller kjemokiner og cytokiner og aktiverer og rekrutterer monocytter og nøytrofiler. Neutrofiler fester seg til sopphyphae og degranulat, noe som resulterer i soppdrap. Dette angrepet er mediert av nikotinamid-adenindinukleotidfosfatoksidase. Ved nøytropeni er nøytrofiler ikke tilgjengelige for hyphaldreping og kontroll av soppvekst, slik at voksende hyphae kan spre seg gjennom endotelcelleforingen.8
Kliniske Manifestasjoner
lungene er det vanligste stedet FOR IA. FØLGELIG ER IA symptomer og kliniske manifestasjoner vanligvis lunge. I en studie observert Lee og kollegaer IA-symptomer hos 36 pasienter og fant at hemoptysis var den vanligste kliniske manifestasjonen (72%), etterfulgt av hoste, kortpustethet og tretthet.9 etterforskerne bemerket at IA-symptomer varierte fra asymptomatisk til massiv hemoptyse (noen ganger dødelig), og frekvensen av symptomstart varierte basert på pasientens immunsystem. Pasienter med en viss grad av immunsuppresjon (f. eks. Diabetes mellitus, alkoholisme) kan gi raskere utvikling av symptomer (dvs.uker i stedet for måneder).10 i en 6-årig undersøkelse Utført Av Cornillet og kollegaer var feber det vanligste kliniske tegnet hos IA-pasienter, og presenterer hos 85% av pasientene (n = 88); brystsmerter var også vanlige.11 Andre symptomer inkluderer vekttap, svette og anoreksi.10
Diagnose
Dyrking av vev er for tiden gullstandarden for diagnose AV IA.11 Denne metoden gir Ikke Bare Aspergillus spp, men definerer videre terapeutiske alternativer via følsomhetstesting. Invasiviteten av å skaffe vev gjør imidlertid dyrking mindre ønskelig. I fravær av vevsprøver kan bronchoalveolar lavage (BAL) væske oppnådd fra øvre og nedre luftveier tjene til å etablere diagnosen IA.12 SELV OM BAL er en sikker prosedyre, er den generelle følsomheten til kultur ved BRUK AV BAL-prøver relativt lav(estimert til 50%).13 blodprøvetaking er den optimale ikke-invasive diagnostiske tilnærmingen for IA.12 Til tross for denne noninvasiveness, Derimot, Aspergillus spp er sjelden isolert fra blod gjennom konvensjonelle kultur teknikker-derav avhengighet av vevsprøver for å sikre en definitiv diagnose AV IA.12 siden resultater fra kulturer er relativt sakte å oppnå samlet, ER IA godt etablert når kulturen er positiv. Disse utfordringene har resultert i utvikling av diagnostiske metoder som er mindre invasive og raskere.
serum galactomannan-analysen er en hurtigtest som er godkjent for å diagnostisere mistenkte tilfeller AV IA hos pasienter med hematologiske maligniteter eller Hsct.13 Galaktomannan, et polysakkarid som frigjøres i kroppsvæsker under Aspergillus-vekst, kan påvises i serum-og BAL-prøver flere dager før kliniske tegn og symptomer vises.13 serumdeteksjon kan lette etableringen av en spesifikk diagnose, MENS BAL-væske ser ut til å ha høyere følsomhet, men ofte er vanskeligere å oppnå.12,13 Meersseman og kolleger rapporterte sensitiviteten av galaktomannan deteksjon å være 88% FOR BAL versus 42% for serum, og spesifisiteten av galaktomannan for BÅDE BAL og serum var 86%.14 et positivt serumresultat kan muliggjøre initiering av antifungale midler, mens et negativt resultat potensielt kan forhindre bruk av dyre og giftige antifungale legemidler.12 Måling av (1,3)-beta-d-glukan i blodet kan også være nyttig som screeningsverktøy for IA. Selv om galaktomannan-analysen er spesifikk for IA, kan (1,3)-beta-d-glukan-analysen også oppdage andre invasive soppsykdommer, inkludert candidiasis, andre muggpatogener og Pneumocystis jiroveci.15
Ledelse
Soppdrepende behandling forblir bærebjelken i behandling AV IA.2 for å forhindre komplikasjoner og dårlige resultater, bør antifungal behandling påbegynnes umiddelbart hos pasienter med høy risiko for IA.2 Infectious Diseases Society Of America (IDSA) anbefaler bruk av vorikonazol for primær behandling av invasiv pulmonal aspergillose, samt for andre manifestasjoner, som aspergilloseinfeksjoner i bihulene, aspergillose i sentralnervesystemet og kronisk nekrotiserende lungespergillose.2 hvis primærbehandling mislykkes, kan lipidformuleringer av amfotericin B (AMB), caspofungin og itrakonazol brukes som restitusjonsbehandling.2 IDSA-retningslinjene anbefaler også bruk av posakonazol som profylakse hos nøytropene pasienter med myelodysplasi og leukemi, samt hos allogene hsct-mottakere med graft-versus-host-sykdom (GvHD).2
Empirisk Behandling
Vorikonazol: En randomisert, ikke-blindet studie som sammenlignet vorikonazol med AMB, fant at 52,8% av vorikonazolpasientene opplevde vellykkede resultater (fullstendig eller delvis oppløsning av lesjoner på radiologi).16 vorikonazolgruppen hadde også en høyere overlevelsesrate enn amb-pasienter (70,8% vs. 57.9%) og færre bivirkninger (343 hendelser vs. 421 hendelser; P = .02), ledende etterforskere å konkludere med at vorikonazol er bedre ENN AMB.16 vorikonazoldosen anbefalt AV IDSA-retningslinjene (TABELL 1) ble støttet i denne studien.2 Vorikonazol har en negativ effektprofil som inkluderer hudfølsomhet ved eksponering for direkte sollys, synsforstyrrelser og hepatotoksisitet preget av økning i serumbilirubin og leverenzymer.2
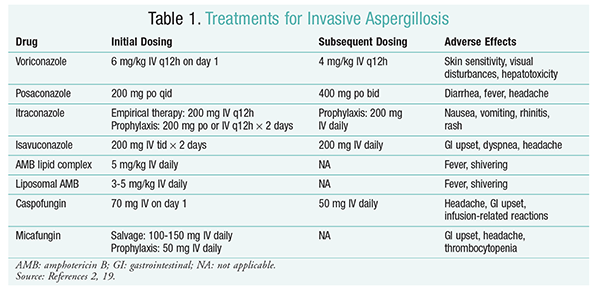
AMB: TIDLIGERE VAR amb deoksykolat standard for omsorg for aspergillose. Infusjonsrelaterte reaksjoner (inkludert feber, rigor, artralgi, oppkast og bronkospasmer) og nefrotoksisitet som fører til potensiell nyresvikt, har imidlertid ført TIL AT AMB faller i unåde.2 i Tillegg kan azotemi oppstå når amb deoksykolat administreres samtidig med nefrotoksiske midler(f. eks. ciklosporin eller takrolimus).2 SOM et resultat anbefaler IDSA lipidkompleksformuleringer som et alternativ, da forekomsten av bivirkninger er lavere enn for deoksykolatformuleringen. I en Studie Utført Av Walsh og kolleger som sammenlignet AMB lipidkompleks med caspofungin, var suksessraten tilsvarende (33,7% FOR AMB, 33,9% for caspofungin); derfor viser behandlingsretningslinjene BÅDE amb lipidkompleks og caspofungin som alternativer til vorikonazol.17
Echinokandiner (Caspofungin, Micafungin, Anidulafungin): selv om caspofungin er godkjent for IA-behandling, har micafungin og anidulafungin ikke vist seg å være effektive i primærbehandling av IA og er derfor ikke anbefalt av IDSA.18 Caspofungin kan forårsake hodepine, gastrointestinale forstyrrelser og mulige infusjonsrelaterte reaksjoner på grunn av histaminfrigjøring.2
Isavukonazol: I Mars 2015 godkjente FDA en ny andre generasjons triazol for IA. Markedsført under merkenavnet Cresemba, er isavukonazol tilgjengelig i både orale og I. v. oppløsninger og er indisert for behandling av ia og mucormykose.19 I en sammenligning av isavukonazol og vorikonazol fastslått SECURE-studien at den nye agenten utførte tilsvarende med hensyn til mortalitet uansett årsak og total respons ved behandlingsslutt. Det primære endepunktet for mortalitet uansett årsak ved dag 42 var 19% for isavukonazol og 20% for vorikonazol.20 isavukonazol ble imidlertid ansett som ikke-inferior siden utprøverne brukte en 10% ikke-inferioritetsmargin (KI -7,8 til 5,7). Isavukonazol hadde færre bivirkninger enn vorikonazol, spesielt hendelser som involverte øyne, hud og hepatobiliært system.19 endelig har isavukonazol høy oral biotilgjengelighet, noe som gir et 1: 1-forhold i en konvertering MELLOM IV og orale formuleringer.
Bergingsterapi
IDSA-retningslinjene anbefaler ikke kombinasjonsterapi ved initial behandling av IA. I stedet anbefales berging terapi bare hvis det ikke er klinisk respons på første behandling. Følgelig kan dette innebære å legge til en annen agent eller bytte til en annen medisinering. Posakonazol, itrakonazol, AMB og caspofungin er undersøkt for bruk som bergingsterapi og er anbefalt AV idsa retningslinjer. Walsh og kollegaer undersøkte effekt og sikkerhet av posakonazol 800 mg suspensjon daglig hos pasienter som var intolerante eller ikke reagerte på det første antisvampemidlet.21 den totale suksessraten var 42% for posakonazolgruppen og 26% for kontrollgruppen (P = .006).21 en studie utført Av Ng og Denning viste en responsrate på 40% når en lipidbasert formulering AV AMB ble brukt som restitusjonsbehandling hos IA-pasienter som var refraktære eller intolerante overfor eksisterende behandling.22 Caspofungin ble også undersøkt som restitusjonsbehandling i en ikke-komparativ multisenterstudie av pasienter som var refraktære mot konvensjonell behandling; en gunstig respons forekom hos 44,6 % av pasientene.23
Profylakse
Posakonazol: IDSA-retningslinjene anbefaler bruk av posakonazol som profylakse av IA. Denne anbefalingen er basert på to randomiserte, kontrollerte multisenterstudier som evaluerte profylaktisk bruk av posakonazol hos pasienter med nøytropeni og GvHD.24,25 i den første studien sammenlignet posakonazol (3 × 200 mg/dag) med flukonazol (1 × 400 mg) eller itrakonazol (2 × 200 mg). IA ble rapportert hos 1% av pasientene i posakonazolgruppen mot 7% av pasientene i flukonazol-og itrakonazolgruppen (P <.001).26 den andre studien sammenlignet posakonazol med flukonazol for profylakse hos pasienter med GvHD. IA var mindre hyppig i posakonazol-gruppen enn i flukonazol-gruppen (1,0% vs. 5,9%; P = .001).25
Micafungin: SELV om DET ikke er godkjent for førstelinjeprofylakse av IA, ANBEFALER IDSA-retningslinjene micafungin som et alternativ til posakonazol. Denne anbefalingen er basert på en randomisert, dobbeltblind fase III studie med 882 pasienter som fikk micafungin 50 mg I. V. (1 mg / kg hos pasienter < 50 kg) versus flukonazol 400 mg (8 mg/kg hos pasienter <50 kg). Effekt ble definert som fravær av påvist, sannsynlig eller mistenkt systemisk soppinfeksjon. I den nøytropene fasen var den totale effekten av micafungin bedre enn effekten av flukonazol (80% for micafungin-gruppen vs. 73.5% for flukonazol-gruppen; 95% KI, 0,9%-12%; P = .03).27
Konklusjon
IA er en alvorlig soppinfeksjon som forekommer oftest hos immunsupprimerte pasienter. Flere spørsmål må tas opp i diagnose, behandling og forebygging av aspergillose. Diagnostiske kriterier er dårlig definert, noe som gjør diagnosen IA utfordrende. På grunn av den høye risikoen for dødsfall, må antifungal behandling initieres raskt og korrekt for å være effektiv. Det foreligger kritiske mangler vedrørende bruk av kombinasjonsbehandling, verktøy for tidlig deteksjon og pasientpopulasjoner der profylakse vil være mest fordelaktig.2 derfor er det viktig for farmasøyter å ha kunnskap om hvert soppdrepende middels egenskaper for å være best rustet til å ta gode terapeutiske beslutninger i behandlingen av IA. Faktisk, gitt den økte risikoen for antifungal resistens, kan farmasøyter spille en viktig rolle i styringen av IA ved å bistå i minimering og håndtering av bivirkninger, lage passende doseringsanbefalinger og overvåke valg av egnede antifungale midler—som alle er kritiske for å optimalisere terapi for IA.
1. Denning DW. Invasiv aspergillose. Clin Infisere Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Behandling av aspergillose: klinisk praksis retningslinjer For Infectious Diseases Society Of America. Clin Infisere Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Pulmonal aspergillose: en klinisk gjennomgang. Eur Respir Rev. 2011;20:156-174.
4. Barnes PD, Marr KA. Aspergillose: spektrum av sykdom, diagnose og behandling. Infisere Denne Clin Nord Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. Invasiv aspergillose i intensivavdelingen. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. En statistisk tilnærming i human brain connectome Av Parkinsons sykdom hos eldre mennesker som bruker Nettverksbasert Statistikk. Conf Proc Ieee Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergillose case-fatality rate: systematisk gjennomgang av litteraturen. Clin Infisere Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogenesen Av Aspergillus fumigatus i invasiv aspergillose. Clin Mikrobiol Rev. 2009;22:447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Kliniske manifestasjoner og behandlingsresultater av pulmonal aspergillom. Koreansk J Intern Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Det kliniske spekteret av pulmonal aspergillose. Thorax. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Sammenligning av epidemiologiske, kliniske og biologiske egenskaper ved invasiv aspergillose hos nøytropene og ikke-nøytropene pasienter: en 6-årig undersøkelse. Clin Infisere Dis. 2006;43:577-584.
12. Jørgensen B, Fredricks D, Leisenring W, et al. Aspergillus galactomannan enzymimmunoassay og kvantitativ PCR for diagnose av invasiv aspergillose med bronkoalveolær skyllevæske. J Clin Mikrobiol. 2004;42:5517-5522.
13. Hvete LJ, Walsh TJ. Diagnose av invasiv aspergillose ved galaktomannan antigenemi deteksjon ved hjelp av et enzymimmunoassay. Eur J Clin Mikrobiol Infiserer Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Invasiv aspergillose hos kritisk syke pasienter uten malignitet. Er J Respir Crit Omsorg Med. 2004;170:621-625.
15. Sherif R, Segal BH. Pulmonal aspergillose: klinisk presentasjon, diagnostiske tester, ledelse og komplikasjoner. Currr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Vorikonazol versus amfotericin B for primær behandling av invasiv aspergillose. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungin versus liposomalt amfotericin B for empirisk antifungal behandling hos pasienter med vedvarende feber og nøytropeni. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungin (FK463), alene eller i kombinasjon med andre systemiske antifungale midler, til behandling av akutt invasiv aspergillose. J Infisere. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavukonazol: et nytt alternativ for behandling av invasive soppinfeksjoner. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavukonazol versus vorikonazol for primær behandling av invasiv muggsykdom forårsaket Av Aspergillus og ANDRE filamentøse sopp (SECURE): en fase 3, randomisert kontrollert, ikke-inferioritetsstudie. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et al. Behandling av invasiv aspergillose med posakonazol hos pasienter som er resistente mot eller intolerante overfor konvensjonell behandling: en ekstern kontrollert studie. Clin Infisere Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Liposomal amfotericin B (AmBisome) terapi ved invasive soppinfeksjoner. Evaluering Av storbritannia compassionate use data. Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Effekt og sikkerhet av caspofungin ved behandling av invasiv aspergillose hos pasienter som er refraktære eller intolerante overfor konvensjonell antifungal behandling. Clin Infisere Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, Et al. Posakonazol vs. flukonazol eller itrakonazol profylakse hos pasienter med nøytropeni. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.