us Pharm. 2016; 41(4):HS15-HS20.
resumo: a aspergilose invasiva (IA) é uma infecção fúngica rara e grave que afecta frequentemente doentes imunocomprometidos. A incidência precisa de AI não foi documentada e as taxas de incidência notificadas variam muito. Alguns fatores de risco típicos para a IA incluem transplantes de células-tronco hematopoiéticas, terapia corticosteróide de longo prazo, neoplasias hematológicas e HIV. Os pulmões são o local mais frequente de IA; consequentemente, os sintomas e manifestações clínicas são tipicamente pulmonares. Devido ao elevado risco de morte, a gestão de IA com os agentes apropriados deve começar o mais rapidamente possível. Voriconazol é a primeira linha de terapia empírica recomendado pela Sociedade de Doenças Infecciosas da América diretrizes; se não houver resposta clínica, em seguida, terapia de resgate com outros azoles, echinocandins, ou anfotericina B lipídica formulações deve ser administrado.
aspergilose é uma infecção fúngica causada por Aspergillus, que compreende um grande grupo de espécies de bolor ubíquas (spp) mais frequentemente encontradas na vegetação em decomposição.1 a aspergilose, que é mais comumente observada em pessoas imunocomprometidas, é uma causa significativa de morbilidade e mortalidade nesta população, com taxas de mortalidade tão elevadas como 90%.Existem vários tipos de infecções por aspergilose, incluindo aspergilose broncopulmonar alérgica, Aspergillus sinusite alérgica, aspergiloma, aspergilose pulmonar crónica, aspergilose cutânea e aspergilose invasiva (IA). A maioria destas infecções é causada por Aspergillus fumigatus, seguida por Aspergillus flavus, Aspergillus niger e Aspergillus terreus.4-6 IA, em particular, é uma das mais graves infecções por aspergilose, e tem uma elevada taxa de mortalidade.5
etiologia e Epidemiologia
os factores de risco comuns para a IA incluem transplante de células estaminais hematopoiéticas (HSCT), neutropenia prolongada e grave, neoplasias hematológicas, terapêutica corticosteróide a longo prazo e VIH. No entanto, certas populações imunocompetentes da UCI, tais como doentes com doença pulmonar obstrutiva crónica, doença hepática grave ou doenças críticas que perturbam temporariamente o sistema imunitário, também apresentam um risco aumentado para a IA.A incidência de IA numa UCI típica é de 0, 33% a 6, 9%, o que é comparável à incidência em doentes transplantados de órgãos sólidos.4,5
aspergilose não é uma infecção relatável nos Estados Unidos porque é incomum e não é considerada uma ameaça grave para a saúde pública.Como resultado, a incidência exacta da avaliação de impacto não foi documentada. Além disso, as taxas de incidência relatadas podem variar substancialmente, sugerindo que a geografia pode desempenhar um papel.4 entre os receptores de transplante, a incidência de IA varia, com condições subjacentes comuns, incluindo linfoma e leucemia.Entre os receptores de transplantes de órgãos sólidos, a incidência de AI é mais elevada nos receptores de transplante de pulmão e fígado (2, 4% – 6% e 1%-8%, respectivamente) do que nos receptores de transplante de rim e coração (0, 1% – 4% e 0, 3%-6%, respectivamente).4 a incidência de IA nos receptores HSCT é ainda maior. Os receptores alogénicos de HSCT têm uma incidência IA de 2, 3% a 11%, o que é mais do dobro da taxa de incidência observada nos receptores autólogos de HSCT (0, 5% – 4%).4 a taxa global de casualidade foi calculada em 58%.7,8 no entanto, as taxas de mortalidade de casos de IA variam em função da condição subjacente. Numa revisão sistemática de 53 estudos entre 1995 e 1999, a taxa de casos fatais nos doentes IA foi mais elevada nos doentes com história de transplante de medula óssea (86,7%) ou VIH/SIDA (85,7%) e mais baixa nos doentes com leucemia ou linfoma (49,3%).7
patogénese
após a inalação de uma fumigatus conidia (esporos aerotransportados), as células epiteliais respiratórias e os macrófagos alveolares desencadeiam respostas imunitárias inatas contra Aspergillus conidia inalada. Estes patógenos então reconhecem receptores nas células hospedeiras, como o receptor beta-glucano Dectin-1. A interacção entre agentes patogénicos e receptores provoca quimioquinas e citoquinas e activa e recruta monócitos e neutrófilos. Os neutrófilos ligam-se a hifas fúngicas e a degranulatos, resultando numa matança fúngica. Este ataque é mediado pela nicotinamida adenina dinucleótido fosfato oxidase. Em caso de neutropenia, os neutrófilos não estão disponíveis para a occisão hifal e para o controlo do crescimento fúngico, pelo que as hifas em crescimento podem então espalhar-se através do revestimento das células endoteliais.8
manifestações clínicas
os pulmões são o local de IA mais comum. Consequentemente, os sintomas de IA e as manifestações clínicas são tipicamente pulmonares. Em um estudo, Lee e colegas observaram sintomas de IA em 36 pacientes e descobriram que a hemoptise foi a manifestação clínica mais comum (72%), seguida de tosse, falta de ar e fadiga.Os investigadores observaram que os sintomas IA variavam de assintomática a hemoptise maciça (por vezes fatal), e a taxa de aparecimento dos sintomas variava com base no sistema imunitário do doente. Doentes com algum grau de imunossupressão (p. ex. Os doentes com SIDA, a utilização de corticosteróides, a diabetes mellitus, o alcoolismo) podem apresentar um desenvolvimento mais rápido dos sintomas (isto é, semanas em vez de meses).10 em uma pesquisa de 6 anos realizada por Cornillet e colegas, a febre foi o sinal clínico mais comum em pacientes IA, apresentando em 85% dos pacientes (n = 88); dor torácica também foi comum.Os sintomas adicionais incluem perda de peso, suores e anorexia.10
diagnóstico
a cultura de tecidos é actualmente o padrão-ouro para o diagnóstico de IA.Este método não só produz Aspergillus spp, como também define opções terapêuticas através de testes de susceptibilidade. No entanto, a invasividade da obtenção de tecido torna a cultura menos desejável. Na ausência de amostras de tecido, o líquido de lavagem broncoalveolar (BAL) obtido a partir dos tractos respiratórios superior e inferior pode servir para estabelecer o diagnóstico de IA.Embora o BAL seja um procedimento seguro, a sensibilidade global da cultura utilizando amostras BAL é relativamente baixa (estimada em 50%).13 a amostragem de sangue é a melhor abordagem de diagnóstico não invasivo para os IA.No entanto, apesar desta não invasividade, Aspergillus spp raramente são isoladas do sangue através de técnicas de cultura convencionais—daí a confiança em espécimes de tecidos para garantir um diagnóstico definitivo de IA.12 Uma vez que os resultados das culturas são relativamente lentos para obter globalmente, a avaliação de Impacto está bem estabelecida quando a cultura é positiva. Estes desafios resultaram no desenvolvimento de métodos diagnósticos menos invasivos e mais rápidos.
o doseamento de galactomanano sérico é um teste rápido aprovado para diagnosticar casos suspeitos de IA em doentes com neoplasias hematológicas ou TH.O galactomanano, um polissacárido libertado em fluidos corporais durante o crescimento de Aspergillus, pode ser detectado em amostras de soro e BAL vários dias antes de aparecerem sinais e sintomas clínicos.A detecção do soro pode facilitar o estabelecimento de um diagnóstico específico, enquanto que o fluido BAL parece ter uma sensibilidade mais elevada, mas é muitas vezes mais difícil de obter.12,13 Meersseman e colegas relataram que a sensibilidade da detecção do galactomanano foi de 88% para o BAL versus 42% para o soro, e a especificidade do galactomanano tanto para o BAL como para o soro foi de 86%.Um resultado sérico positivo pode permitir o início de agentes antifúngicos, enquanto um resultado negativo pode potencialmente impedir o uso de medicamentos antifúngicos caros e tóxicos.12 A Medição do (1,3)-beta-D-glucano no sangue pode também ser útil como ferramenta de rastreio para a IA. Embora o doseamento de galactomanano seja específico para a IA, o doseamento de (1,3)-beta-D-glucano também pode detectar outras doenças fúngicas invasivas, incluindo candidíase, outros agentes patogénicos para os fungos e Pneumocystis jiroveci.15
Gestão
o tratamento antifúngico continua a ser o principal pilar do tratamento da IA.2 de modo a prevenir complicações e resultados negativos, o tratamento antifúngico deve ser iniciado imediatamente em doentes com risco elevado de AI.2 A Infectious Diseases Society of America (IDSA) recomenda o uso de voriconazol para o primário o tratamento de aspergilose pulmonar invasiva, bem como para outras manifestações, como a aspergilose infecções dos seios da face, sistema nervoso central, aspergilose, e enterocolite crônica aspergilose pulmonar.2 Se o tratamento primário falhar, as formulações lipídicas de anfotericina B (AMB), caspofungina e itraconazol podem ser utilizadas como terapêutica de recurso.As orientações do IDSA também recomendam o uso de posaconazol na profilaxia em doentes neutropénicos com mielodisplasia e leucemia, bem como em receptores alogénicos de HSCT com doença enxerto-versus-hospedeiro (GvHD).2
Tratamento Empírico
Voriconazol: Um estudo randomizado, nãocego de avaliação a comparação de voriconazol com a AMB descobriu que 52,8% do voriconazol pacientes tiveram resultados bem sucedidos (completa ou parcial de resolução das lesões em radiologia).O grupo tratado com voriconazol também apresentou uma taxa de sobrevivência superior à dos doentes com BMA (70, 8% vs. 57).9%) e menos acontecimentos adversos (343 acontecimentos vs. 421 acontecimentos; P = .02), levando os investigadores a concluir que o voriconazol é superior ao AMB.A dose de voriconazol recomendada pelas orientações do IDSA (Tabela 1) foi suportada neste ensaio.O voriconazol tem um perfil de efeitos adversos que inclui sensibilidade cutânea com exposição à luz solar directa, perturbações visuais e hepatotoxicidade caracterizada por um aumento na bilirrubina sérica e enzimas hepáticas.2
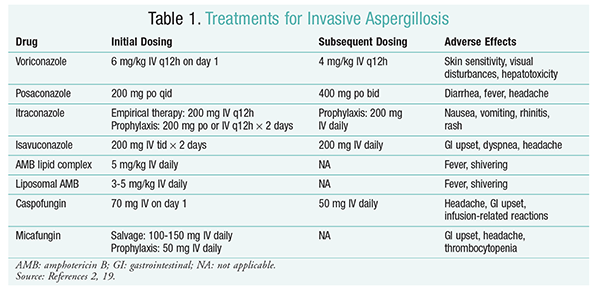
AMB: anteriormente, o desoxicolato de AMB era o padrão de cuidados para a aspergilose. No entanto, as reacções relacionadas com a perfusão (incluindo febre, calafrios, artralgias, vómitos e broncospasmos) e nefrotoxicidade, resultando em potencial insuficiência renal, fizeram com que a AMB caísse em desuso.Adicionalmente, pode ocorrer azotemia quando a AMB deoxicolato é co-administrada com agentes nefrotóxicos (p.ex., ciclosporina ou tacrolimus).Como resultado, o IDSA recomenda formulações complexas de lípidos como alternativa, uma vez que a incidência de efeitos adversos é inferior à da formulação de desoxicolato. Além disso, em um julgamento por Walsh e colegas que, em comparação AMB lipídios complexos com caspofungin, as taxas de sucesso foram similares (33,7% para AMB, 33,9% caspofungin); portanto, as diretrizes de tratamento lista AMB lipídios complexos e caspofungin como alternativas para o voriconazol.17
Equinocandinas (caspofungina, Micafungina, anidulafungina): embora a caspofungina tenha sido aprovada para a terapêutica IA, a micafungina e a anidulafungina não demonstraram ser eficazes no tratamento primário da IA, pelo que não são recomendadas pela IDSA.A caspofungina pode causar cefaleias, distúrbios gastrointestinais e possíveis reacções relacionadas com a perfusão devido à libertação de histamina.2
Isavuconazol: em Março de 2015, a FDA aprovou um novo triazol de segunda geração para o IA. Comercializado sob a designação comercial Cresemba, o isavuconazol está disponível em soluções orais e IV e está indicado para o tratamento da IA e mucormicose.Numa comparação entre o isavuconazol e o voriconazol, o estudo seguro determinou que o novo agente actuou de forma semelhante no que respeita à mortalidade por todas as causas e à resposta global no final da terapêutica. O objectivo primário da mortalidade por todas as causas até ao dia 42 foi 19% para o isavuconazol e 20% para o voriconazol.No entanto, o isavuconazol foi considerado não inferior, uma vez que os investigadores utilizaram uma margem de não inferioridade de 10% (CI-7, 8 a 5, 7). O isavuconazol teve menos acontecimentos adversos do que o voriconazol, particularmente acontecimentos envolvendo os olhos, pele e sistema hepatobiliar.Por último, o isavuconazol apresenta uma elevada biodisponibilidade oral, produzindo um rácio de 1:1 numa conversão entre as formulações IV e oral.As normas orientadoras do IDSA não recomendam terapêutica combinada para o tratamento inicial de IA. Em vez disso, a terapêutica de recurso só é recomendada se não Houver resposta clínica à terapêutica inicial. Consequentemente, isto pode envolver a adição de um segundo agente ou a mudança para outro medicamento. Posaconazol, itraconazol, AMB e caspofungina foram estudados para utilização como terapêutica de recurso e são recomendados pelas normas orientadoras do IDSA. Walsh e os colegas investigaram a eficácia e segurança de posaconazol 800 mg suspensão diária em doentes que eram intolerantes ou não respondem ao agente antifúngico inicial.A taxa global de sucesso foi de 42% para o grupo posaconazol e de 26% para o grupo controlo (P = .006).Um estudo realizado pelo Ng e Denning demonstrou uma taxa de resposta de 40% quando foi utilizada uma formulação de AMB baseada em lípidos como terapêutica de recurso em doentes IA refractários ou intolerantes à terapêutica existente.A caspofungina foi também examinada como terapêutica de recurso num estudo multicêntrico não comparativo de doentes refractários à terapêutica convencional; ocorreu uma resposta favorável em 44, 6% dos doentes.23
profilaxia
posaconazol: as orientações da IDSA recomendam a utilização de posaconazol na profilaxia da IA. Esta recomendação baseia-se em dois ensaios multicêntricos, aleatorizados e controlados, que avaliaram a utilização profiláctica de posaconazol em doentes com neutropenia e GvHD.24,25 o primeiro ensaio comparou posaconazol (3 × 200 mg/dia) com fluconazol (1 × 400 mg) ou itraconazol (2 × 200 mg). A AI foi notificada em 1% dos doentes no grupo do posaconazol versus 7% dos doentes nos grupos do fluconazol e do itraconazol (P <.001).O segundo estudo comparou posaconazol com fluconazol para profilaxia em doentes com GvHD. A AI foi menos frequente no grupo do posaconazol do que no grupo do fluconazol (1, 0% vs. 5, 9%; P = .001).25
Micafungina: Embora não aprovado para a profilaxia de primeira linha da IA, as orientações IDSA recomendam a micafungina como alternativa ao posaconazol. Esta recomendação baseia-se num ensaio aleatorizado, em dupla ocultação, de fase III, em 882 doentes que receberam 50 mg de micafungina IV (1 mg/kg em doentes <50 kg) versus 400 mg de fluconazol (8 mg/kg em doentes <50 kg). A eficácia foi definida como uma ausência de infecção fúngica sistémica comprovada, provável ou suspeita. Durante a fase neutropénica, a eficácia global da micafungina foi superior à do fluconazol (80% no grupo da micafungina vs. 73.5% para o grupo do fluconazol; IC 95%, 0, 9% – 12%; P = .03).27
conclusão
IA é uma infecção fúngica grave que ocorre mais frequentemente em doentes imunocomprometidos. Várias questões precisam ser abordadas no diagnóstico, tratamento e prevenção da aspergilose. Os critérios de diagnóstico são mal definidos, tornando o diagnóstico de IA desafiador. Devido ao alto risco de fatalidade, a terapia antifúngica deve ser iniciada rápida e corretamente para ser eficaz. Existem lacunas críticas no que diz respeito ao uso de terapia combinada, ferramentas para detecção precoce e as populações de pacientes nas quais a profilaxia seria mais benéfica.Por conseguinte, é importante que os farmacêuticos conheçam as características de cada agente antifúngico, a fim de estarem mais bem equipados para tomar decisões terapêuticas sólidas no tratamento da IA. De fato, dado o aumento do risco de resistência antifúngica, os farmacêuticos podem desempenhar um papel importante na gestão de IA auxiliando na minimização e gestão de efeitos adversos, fazer recomendações de dosagem e monitoramento da seleção adequada de antifúngicos—todos os quais são essenciais para a otimização da terapia para IA.
1. Denning DW. Aspergilose invasiva. Clin Infect Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Aspergilose pulmonar: a clinical review. EUR Respir Rev. 2011; 20: 156-174.
4. Barnes PD, Marr KA. Aspergilose: espectro de doença, diagnóstico e tratamento. Infect Dis Clin North Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. aspergilose invasiva na unidade de cuidados intensivos. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian a, Mohajer B, et al. A statistical approach in human brain connectome of Parkinson disease in elderly people using Network Based Statistics. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Caso de aspergilose-taxa de mortalidade: revisão sistemática da literatura. Clin Infect Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogénese de Aspergillus fumigatus na aspergilose invasiva. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Manifestações clínicas e resultados de tratamento do aspergiloma pulmonar. Medicina Interna Coreana. 2004;19:38-42.
10. Kosmidis C, Denning DW. O espectro clínico da aspergilose pulmonar. Torax. 2015;70:270-277.
11. Cornillet a, Camus C, Nimubona S, et al. Comparação das características epidemiológicas, clínicas e biológicas da aspergilose invasiva em doentes neutropénicos e não-autropénicos: um estudo de 6 anos. Clin Infect Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Imunoensaio enzimático Aspergillus galactomannanan e PCR quantitativa para diagnóstico de aspergilose invasiva com fluido de lavagem broncoalveolar. J Clin Microbiol. 2004;42:5517-5522.
13. Wheat LJ, Walsh TJ. Diagnóstico de aspergilose invasiva por Detecção de antigenemia galactomanana utilizando um imunoensaio enzimático. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Aspergilose invasiva em doentes criticamente doentes sem malignidade. Am J Respir Crit Care Med. 2004;170:621-625.
15. Xerife R, Segal BH. Aspergilose pulmonar: apresentação clínica, testes de diagnóstico, gestão e complicações. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazol versus anfotericina B para a terapêutica primária de aspergilose invasiva. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungina versus anfotericina B lipossómica para a terapêutica antifúngica empírica em doentes com febre persistente e neutropenia. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungina (FK463), isolada ou em combinação com outros agentes antifúngicos sistémicos, para o tratamento da aspergilose invasiva aguda. Infectar. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavuconazol: uma nova opção para o tratamento de infecções fúngicas invasivas. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazol versus voriconazol para o tratamento primário da doença dos bolores invasivos causada por Aspergillus e outros fungos filamentosos (SECURE): um ensaio de Fase 3, aleatorizado, controlado, de não inferioridade. Lanceta. 2016;387:760-769.
21. Walsh TJ, Raad i, Patterson TF, et al. Tratamento da aspergilose invasiva com posaconazol em doentes refractários ou intolerantes à terapêutica convencional: um ensaio controlado externamente. Clin Infect Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Terapêutica com anfotericina B lipossómica (Ambisoma) em infecções fúngicas invasivas. Avaliação dos dados do Reino Unido sobre o uso compassivo. Medicina Interna Arch. 1995;155:1093-1098.
23. Maertens J, Raad i, Petrikkos G, et al. Eficácia e segurança da caspofungina no tratamento da aspergilose invasiva em doentes refractários ou intolerantes à terapêutica antifúngica convencional. Clin Infect Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Posaconazol vs. Fluconazol ou profilaxia com itraconazol em doentes com neutropenia. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.