i kemi är ekvivalenspunkt en term som används vid titrering. Den applicerartill någon syrabas eller neutraliseringsreaktion Tekniskt.
Definition:
ekvivalenspunkten för en kemisk reaktion är den punkt där lika stora mängder reaktanter blandas kemiskt.
med andra ord, medan titrering är det en punkt där mängden tillsatt titrant är tillräckligt för att neutralisera analytlösningen helt. Antalet mol titrant d. v. s. standardlösningen är lika med Molen i en lösning som har en okänd koncentration. Det är också känt som stökiometrisk punkt eftersom det är en punkt där Molen syra är lika med Molen i basen som behövs för att neutralisera lösningen. Observera att syra till basförhållande inte behöver vara 1: 1. Detta syra-basförhållande förklaras av den balanserade syra-bas kemiska ekvationen. Indikatorer kan användas för detta ändamål, till exempel metylorange eller fenolftalein.

ekvivalenspunktenkan inte tas på samma sätt som slutpunkten för en titrering. Slutpunkten hänvisas till som den punkt där den använda indikatorn ändrar sin färg. Dessafärgförändringar visas efter att ha nått ekvivalenspunkten. Om vi använder Endpoint för att bestämma ekvivalens, kommer det att inducera ett fel.
metoder för bestämning av ekvivalenspunkten:
det finns olikametoder för bestämning av ekvivalenspunkten. De diskuteras somföljer:
- pH-indikator
- konduktans
- färgförändring
- nederbörd
- isotermisk kalorimetri
- Termometrisk titrimetri
- spektroskopi
- Amperometri
pH-indikator:
APH-indikator är ett kemiskt ämne som ändrar färg som reaktion på Någonkemisk förändring. En syrabasindikator, till exempel, ändras fenolftaleindess färg som beror på dess pH. Redoxindikatorer kan också användas för dettaändamål. Ursprungligen läggs bara en enda droppe indikatorlösning tilltitrering. Färgförändringen visar att slutpunkten har uppnåtts.Detta kommer att vara en uppskattning av ekvivalenspunkten.
konduktans:
den elektriska ledningsförmågan hos en lösning påverkas av jonerna. Hencekonduktiviteten förändras när de reagerar med varandra. (till exempel, medanutför en syrabastitrering, H3O+ och OH-jonerna reagerar och bildar neutralt vatten, H20 – lösning). Konduktans är relativt en svår metod fördriva, speciellt när de joner som är närvarande i lösningen kandelta i konduktivitet. Konduktans kan användas för några syrabaserreaktioner.
färgförändring:
Videkvivalenspunkten kommer lösningen att ändra sin färg naturligt utan någontillägg av en indikator i vissa reaktioner. Detta kan observeras vid övergångmetaller där oxidationstillståndet består av olika färger.
nederbörd:
under titrering kommer fällningen att bildas omreaktionen bildar en fast substans. Ett bra exempel på Utfällning är reaktionenmellan silver, Ag+ och klor, Cl – vilket resulterar i bildandet av ettolösligt salt, silverklorid, AgCl. Oväntat gör detta det mycket svårt attbestämma slutpunkterna exakt på grund av partikelstorlek, hastigheten på sedimentering och färg gör det mycket svårt att se. Detta är anledningen till attutfällningstitrering görs som backtitreringar.
isotermisk kalorimetri:
bestämningen av ekvivalenspunkten görs genom att beräkna mängden värmesom produceras eller absorberas med hjälp av en anordning som kallas en isotermisk titrationkalorimeter. Denna typ används vanligtvis i titreringar som involverar biokemiskreaktioner, dvs som enzymbindning.
Termometrisk titrimetri:
Termometrisktitrimetri är en exceptionellt mångfacetterad teknik. Här bestäms ekvivalenspunkten genom mätning av temperaturförändringshastigheten som produceras genom achemisk reaktion. Den här egenskapen skiljer den från kalorimetriktitrimetri. Eftersom termometrisk titrimetri är en relativ teknik är det intenödvändigt att utföra titreringen under isotermiska förhållanden. Denna typ avtitrering kan utföras i plast eller till och med i glasbehållare. För att förhindrasprutdrag är dessa kärl vanligtvis inneslutna genom att orsaka buller som stör slutpunkten. På grund av förmågan hos denna typ av titrering att beconducted under omgivande förhållanden, de är lämpliga för rutin processand kvalitetskontroll i branschen. Temperaturen kommer antingen att öka ellerminskning under titreringsprocessen, beroende på om reaktionen tar plats mellan titranten och analyten är exoterm eller endoterm. Ittitrering när all analyt har förbrukats av reaktionen förändras temperaturhastigheten, dvs. en ökning eller minskning bestämmer ekvivalensenpunkt och böjning i temperaturkurvan kan observeras. Ekvivalenspunkten kan observeras exakt genom att använda det andra derivatet av temperaturkurvan. Programvaran som används i ett modernt automatiserattermometriskt titreringssystem består av regelbundna avancerade digitala algoritmerså att bruset som genereras från mycket känsliga temperaturprober inte orsakar någon störning av utseendet på en vanlig, enhetlig sekundärnivativ topp som beskriver slutpunkten. Denna teknik har förmågan attmycket hög precision och varianskoefficienten (CVs) på mindre än 0,1 ärvanligt. De senaste termometriska titreringstemperaturproberna har en termistorsom bildar en arm av en Wheatstone-bro. det bästa termometriska titrationssystemet kan lösa temperaturen till 10-5 K om den är kopplad till högupplösningselektronik. Om temperaturen ändras under titrering blir somlite som 0,001 K kommer en skarp ekvivalenspunkt att erhållas. Där det finns anenthalpy förändring, kan denna teknik tillämpas nödvändigtvis till någon kemisk reaktioni en vätska, även om reaktionskinetiken spelar en viktig roll i calculating slutpunktens skärpa. Denna punkt av titrimetri har väsentligtappliceras på syrabas, EDTA, REDOX och utfällningstitrering. Viktigtexempel på utfällningstitrering inkluderar:
- Sulfatetitration med Bariumjoner
- Fosfatetitration med Magnesium i ammoniumlösning
- Kloridetitration med silvernitrat
- Nickeltitration med Dimetylglyoxim
- Fluoridetitration med aluminium (som K2NaAlF6)
som icke-vattenhaltiga titreringar kan enkelt utföras som vattenhaltig titrering eftersomtemperaturproben kräver inte att den är elektriskt ansluten till lösningen eftersom den krävs i potentiometriska titreringar. Lösningar som ärmycket grumliga eller färgade kan enkelt analyseras med termometrisk utan någonytterligare behandling av ett prov. Sonden är underhållsfri. Nu en dag genom att använda de senaste och mycket pr-stegmotordrivna buretterna,är termometriska titreringar färdiga inom några minuter, vilket gör thistechnique till ett perfekt val där hög produktion i ett laboratorium behövs.
spektroskopi:
iDenna typ används spektroskopi för att bestämma ekvivalenspunkten om spektrumet för reaktanten, produkten eller titranten är känt. En specifik mängd av produktenoch reaktant används för att hitta ekvivalenspunkten. En mycket låg nivå avfri titrants närvaro kan också bestämmas. Kort sagt används denna metodför att bestämma förekomsten av halvledare.
Amperometri:
Amperometriär en detekteringsteknik som används för att mäta förändringen i strömmen.Amperometri används mest i de titreringar där överskottet av titranten kan minskas. Denna metod är till hjälp vid titrering av en Halid med Ag+ eftersom bildandet av fällningar inte påverkas.
exempel på ekvivalenspunkt:
- reaktionen av en stark syra med en stark bas:
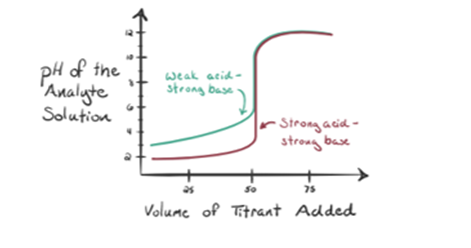
låt anta saltsyra HCl (en stark syra) tas som en analyt och natriumhydroxid NaOH (stark bas) tas som en titrant. Om vi plottar en graf mellan analyt pH och en titrant NaOH som kan läggas till från buretten, kommer en titreringsgraf att bildas som ges nedan:
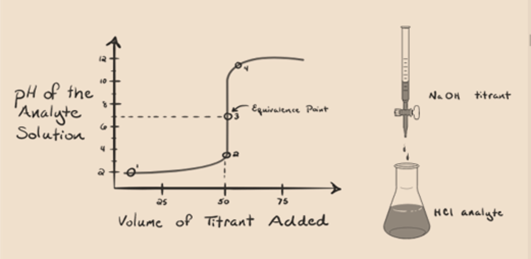
figur 1.1
ovanstående figur 1.1 visar vid punkt 1 att när ingen bas som NaOH läggs till. Analytens pH är lågt eftersom det mestadels innehåller H3O+ från separationen av HCl.

som natriumhydroxid NaOH tillsätts droppe bydrop, det börjar få absorberas av OH-långsamt som produceras bydissociation av NaOH. Den producerade analyten kommer att vara sur på grund av dominerandenärvaro av hydroniumjoner, H3O+.
i figur 1.1 punkt 2 anger den tidpunkt då pH registreras strax innan neutraliseringen sker helt. Medan punkt 3 visar oss ekvivalenspunkten. Här är molen av natriumhydroxid tillsatt lika med molen av hydroxylkloriden i analyten. Detta är den punkt där hydroniumjoner, H3O+ neutraliseras fullständigt av hydroxyljon, OH–. PH=7 eftersom det har salt, NaCl och vatten H2O.
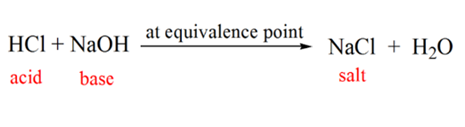
punkt 4 i figur 1.1 visar att när vi fortsätter att lägga till NaOH börjar lösningens pH bli grundläggande på grund av fullständig neutralisering av HCl. Nu finns det gott om OH-joner finns i lösningen som dissocierar från NaOH.
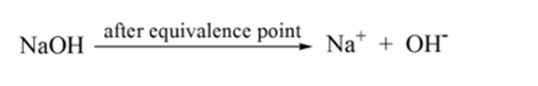
- reaktionen av en svag syra med en stark bas:
låt oss betrakta en svag syra, en ättiksyra CH3COOH och en stark bas natriumhydroxid NaOH som titrant. Om vi plottar ett diagram mellan analytens pH och volymen av NaOH får vi en titreringskurva som visas nedan.
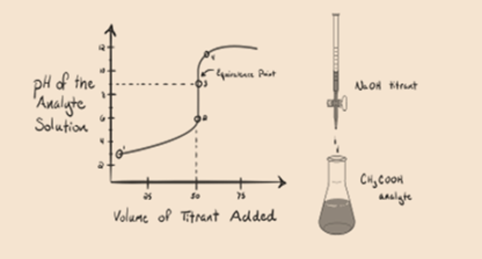
figur 1.2
figur 1.2 visar vid punkt 1 Att NaOH inte tillsätts ännu, så just nu är analytens pH lågt eftersom det för det mesta innehåller H3O+ när CH3COOH dissocierar. Men eftersom ättiksyra är en svag syra, så kommer initialt dess pH att vara högre.

somvi fortsätter att lägga till NaOH droppvis, H3O+ kommer att börja fåkonsumeras av OH-långsamt. Detta kommer att produceras av dissociation ofNaOH. Men här är analyten fortfarande sur på grund av närvaron av H3O+joner mestadels.
Infigure 1.2 punkt 2 indikerar pH som registrerats vid en tidpunkt strax innan aneutralisering sker helt.
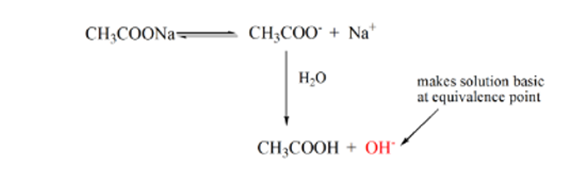
punkt 3 representerar ekvivalenspunkten. Detta är den punkt där mol NaOH är lika med mol CH3COOH i en analyt. Hydroniumjoner neutraliseras fullständigt av hydroxyljoner. Lösningen innehåller sedan CH3COONa-salt och H2O.

notera:
du kan märka en skillnad här jämfört med ett fall 1 med A som har en strongacid titrerad mot en stark bas. I detta fall (svag syra och en starkbas) är pH inte neutralt vid en ekvivalenspunkt. Lösningen har ett pH~9 vid ekvivalenspunkten. Låt oss ta reda på orsaken nedan.
från ovanstående ekvation visas att lösningen innehåller CH3COONa vid ekvivalenspunkten. Detta dissocierar till en natriumjon och acetatjoner. Acetatjon är konjugatbasen för den svaga syran CH3COOH. Därför är CH3COO-relativt en stark bas (dvs svag syra har en stark konjugatbas) därför reagerar de med vatten för att producera hydroxidjoner som ökar pH till nära 9 vid ekvivalenspunkten.
punkt 4 i figur 1.2 visar att när natriumhydroxid är i större mängd kommer den erhållna titreringskurvan att vara identisk med HCl-NaOH.
- Strongsyra med en svag bas:
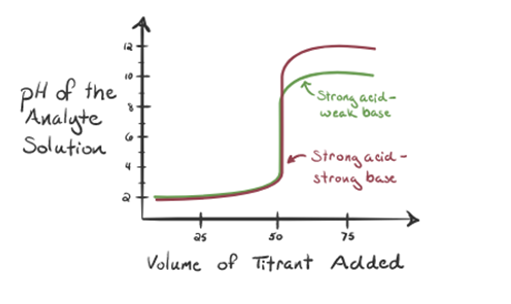
här, låt oss betrakta saltsyra som en stark syra som en analyt och ammoniak som en svag bas som en titrant. Om vi plottar ett diagram mellan pH för analytlösningen och volymen av titrant NH3, kommer vi att få en titreringskurva enligt nedan:
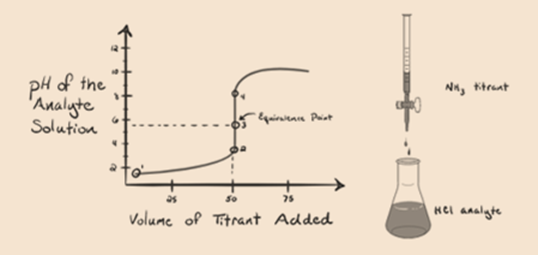
figur 1.3
i figur 1.3 punkt 1 visar att när ingen ammoniak tillsätts kommer analytens pH att vara lågt eftersom det mest innehåller H3O+ från dissociationen av saltsyra.
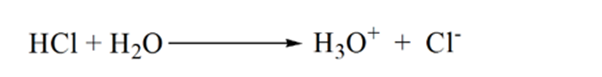
när ammoniak tillsätts droppe för droppe börjar H3O + långsamt konsumeras av ammoniak. Analyten kommer fortfarande att vara sur på grund av majoriteten av H3O+ – joner.
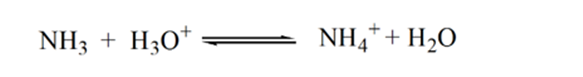
Punkt2 i figur 1.3 indikerar att pH registreras vid en punkt strax innan aneutralisering sker helt.
Punkt3 visar ekvivalenspunkten. Här antalet mol tillsatt Nh3är lika med Molen HCl i analyten. Hydroniumjonerna är fullaneutraliseras av NH3.
Obs:
detär märkt att i fallet med den svaga basen mot en stark syra är phinte neutral vid ekvivalenspunkten. Därför lösningen som uppnåskommer att vara surt med ett pH runt 5,5 vid ekvivalenspunkten.
anledningen till detta är att lösningen vid en ekvivalenspunkt endast har ammoniumjoner NH4 + och kloridjoner, CL-. Eftersom ammoniumjonerna är konjugatsyran av en svag bas, dvs NH3. Därför är NH4+ en stark syra och således kommer NH4+ att reagera med vatten för att producera hydroniumjoner vilket gör lösningen sur.
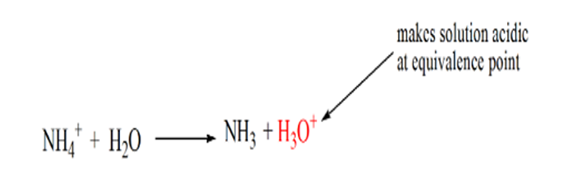
punkt 4 visar att efter att ha uppnått en ekvivalenspunkt fortsätter vi att tillsätta ammoniak och när det är överskott kommer pH att börja öka. Ammoniak är en svag bas så dess pH är över 7 men det som lägre jämfört med en stark bas NaOH visas i fall 1.
- Svagbas med svag syra:
låt oss betrakta ammoniak, en svag bas som en analyt och en ättiksyra som är en svag syra som en titrant. Om vi plottar ett diagram mellan analytlösningens pH kontra volymen av ättiksyra som en titrant, kommer vi att få en titreringskurva enligt nedan:
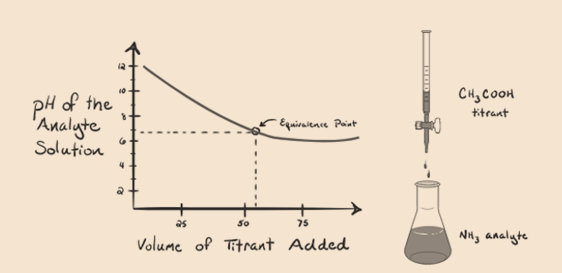
figur 1.4
vi har märkt att det inte finns någon brant i denna grafdiagram. Detta är vad vi kallar en” böjningspunkt ” vid ekvivalenspunkten. Frånvaron av den nödvändiga branta förändringen i pH ger oss inte mycket information genom en sådan kurva.