US Pharm. 2016; 41 (4): HS15-HS20.
RESUMEN: La aspergilosis invasiva (IA) es una infección fúngica grave y poco frecuente que afecta comúnmente a pacientes inmunodeprimidos. No se ha documentado la incidencia precisa de IA, y las tasas de incidencia notificadas varían ampliamente. Algunos factores de riesgo típicos de IA incluyen trasplantes de células madre hematopoyéticas, terapia con corticosteroides a largo plazo, neoplasias hematológicas malignas y VIH. Los pulmones son el sitio más frecuente de IA; en consecuencia, los síntomas y manifestaciones clínicas son típicamente pulmonares. Debido al alto riesgo de muerte, la administración de IA con los agentes apropiados debe comenzar lo antes posible. Voriconazol es la terapia empírica de primera línea recomendada por las directrices de la Sociedad de Enfermedades Infecciosas de América; si no hay respuesta clínica, se debe administrar terapia de rescate con otros azoles, equinocandinas o formulaciones lipídicas de anfotericina B.
La aspergilosis es una infección fúngica causada por Aspergillus, que comprende un gran grupo de especies de moho ubicuo (spp) que se encuentran con mayor frecuencia en la vegetación en descomposición.1 La aspergilosis, que se observa con mayor frecuencia en personas inmunodeprimidas, es una causa importante de morbilidad y mortalidad en esta población, con tasas de mortalidad de hasta el 90%.2,3 Existen varios tipos de infecciones por aspergilosis, como la aspergilosis broncopulmonar alérgica, la sinusitis alérgica por Aspergillus, el aspergiloma, la aspergilosis pulmonar crónica, la aspergilosis cutánea y la aspergilosis invasiva (IA). La mayoría de estas infecciones son causadas por Aspergillus fumigatus, seguido de Aspergillus flavus, Aspergillus niger y Aspergillus terreus.4-6 IA, en particular, es una de las infecciones de aspergilosis más graves, y tiene una alta tasa de mortalidad.5
Etiología y epidemiología
Los factores de riesgo comunes para IA incluyen trasplante de células madre hematopoyéticas (TCMH), neutropenia prolongada y grave, neoplasias hematológicas malignas, terapia con corticosteroides a largo plazo y VIH. Sin embargo, ciertas poblaciones inmunocompetentes en la UCI, como los pacientes con enfermedad pulmonar obstructiva crónica, enfermedad hepática grave o enfermedades críticas que alteran temporalmente el sistema inmunitario, también tienen un mayor riesgo de AI.5 La incidencia de AI en una UCI típica se reporta de 0,33 a 6,9%, lo que es comparable a la incidencia en pacientes con trasplante de órganos sólidos.4,5
La aspergilosis no es una infección notificable en los Estados Unidos porque es poco frecuente y no se considera una amenaza grave para la salud pública.6 Como resultado, no se ha documentado la incidencia exacta de IA. Además, las tasas de incidencia notificadas pueden variar sustancialmente, lo que sugiere que la geografía puede desempeñar un papel.4 Entre los receptores de trasplantes, la incidencia de IA varía, con afecciones subyacentes comunes, como linfoma y leucemia.7 Entre los receptores de trasplante de órganos sólidos, la incidencia de IA es mayor en los receptores de trasplante de pulmón y de hígado (2,4-6% y 1-8%, respectivamente) que en los receptores de trasplante de riñón y corazón (0,1 – 4% y 0,3-6%, respectivamente).4 La incidencia de IA en los receptores de TCMH es aún mayor. Los receptores de TCMH alogénicos tienen una incidencia de IA de 2,3 a 11%, que es más del doble de la tasa de incidencia observada en los receptores de TCMH autólogos (0,5 a 4%).4 Se ha calculado que la tasa global de letalidad es del 58%.7,8 Sin embargo, las tasas de letalidad de IA varían dependiendo de la afección subyacente. En una revisión sistemática de 53 estudios de 1995 a 1999, la tasa de letalidad en pacientes con IA fue más alta en pacientes con antecedentes de trasplante de médula ósea (86,7%) o VIH/SIDA (85,7%) y la más baja en pacientes con leucemia o linfoma (49,3%).7
Patogénesis
Tras la inhalación de un fumigatus conidia (esporas aéreas), las células epiteliales respiratorias y los macrófagos alveolares desencadenan respuestas inmunitarias innatas frente a Aspergillus conidia inhalado. Estos patógenos luego reconocen receptores en las células huésped, como el receptor beta-glucano Dectin-1. La interacción entre patógenos y receptores provoca quimiocinas y citocinas y activa y recluta monocitos y neutrófilos. Los neutrófilos se adhieren a las hifas fúngicas y degranulan, lo que resulta en la eliminación de hongos. Este ataque está mediado por nicotinamida adenina dinucleótido fosfato oxidasa. En el caso de la neutropenia, los neutrófilos no están disponibles para la destrucción de las hifas y el control del crecimiento de los hongos, por lo que las hifas en crecimiento pueden diseminarse a lo largo del revestimiento de las células endoteliales.8
Manifestaciones clínicas
Los pulmones son el sitio más común de IA. En consecuencia, los síntomas y manifestaciones clínicas de IA suelen ser pulmonares. En un estudio, Lee y sus colegas observaron síntomas de IA en 36 pacientes y encontraron que la hemoptisis fue la manifestación clínica más común (72%), seguida de tos, dificultad para respirar y fatiga.9 Los investigadores observaron que los síntomas de IA variaban de asintomáticos a hemoptisis masiva (a veces mortal), y la tasa de aparición de síntomas variaba según el sistema inmunitario del paciente. Pacientes con algún grado de inmunosupresión (p. ej., SIDA, uso de corticosteroides, diabetes mellitus, alcoholismo) puede presentar un desarrollo más rápido de los síntomas (es decir, semanas en lugar de meses).10 En una encuesta de 6 años realizada por Cornillet y colegas, la fiebre fue el signo clínico más común en los pacientes con IA, presentándose en el 85% de los pacientes (n = 88); el dolor torácico también fue común.11 Otros síntomas incluyen pérdida de peso, sudores y anorexia.10
Diagnóstico
El cultivo de tejido es actualmente el estándar de oro para el diagnóstico de IA.11 Este método no solo produce Aspergillus spp, sino que también define las opciones terapéuticas a través de pruebas de susceptibilidad. Sin embargo, la invasividad de obtener tejido hace que el cultivo sea menos deseable. En ausencia de muestras de tejido, el líquido de lavado broncoalveolar (LBA) obtenido de las vías respiratorias superior e inferior puede servir para establecer el diagnóstico de IA.12 Aunque el LBA es un procedimiento seguro, la sensibilidad general del cultivo con muestras de LBA es relativamente baja (estimada en un 50%).13 La toma de muestras de sangre es el abordaje diagnóstico no invasivo óptimo para la IA.12 Sin embargo, a pesar de esta ausencia de invasibilidades, Aspergillus spp rara vez se aísla de la sangre mediante técnicas de cultivo convencionales, de ahí la dependencia de muestras de tejido para asegurar un diagnóstico definitivo de IA.12 Dado que los resultados de los cultivos son relativamente lentos de obtener en general, la IA está bien establecida cuando el cultivo es positivo. Estos desafíos han dado lugar al desarrollo de métodos de diagnóstico menos invasivos y más rápidos.
El ensayo de galactomanano sérico es una prueba rápida aprobada para diagnosticar casos sospechosos de IA en pacientes con neoplasias hematológicas malignas o TCMH.13 El galactomanano, un polisacárido liberado en los fluidos corporales durante el crecimiento de Aspergillus, se puede detectar en muestras de suero y LBA varios días antes de que aparezcan los signos y síntomas clínicos.13 La detección de suero puede facilitar el establecimiento de un diagnóstico específico, mientras que el líquido BAL parece tener una mayor sensibilidad, pero a menudo es más difícil de obtener.12,13 Meersseman y sus colegas informaron que la sensibilidad de la detección de galactomanano fue de 88% para el LBA versus 42% para el suero, y la especificidad del galactomanano para el LBA y el suero fue de 86%.14 Un resultado positivo en suero puede permitir la iniciación de agentes antifúngicos, mientras que un resultado negativo puede prevenir potencialmente el uso de medicamentos antifúngicos costosos y tóxicos.12 La medición de (1,3)-beta-D-glucano en la sangre también puede ser útil como herramienta de detección de IA. Aunque el ensayo de galactomanano es específico para IA, el ensayo de (1,3)-beta-D-glucano también puede detectar otras enfermedades fúngicas invasivas, como la candidiasis, otros patógenos del moho y Pneumocystis jiroveci.15
Manejo
El tratamiento antifúngico sigue siendo el pilar del tratamiento de la IA.2 Para prevenir complicaciones y malos resultados, el tratamiento antifúngico debe iniciarse inmediatamente en pacientes con alto riesgo de IA.2 La Sociedad de Enfermedades Infecciosas de América (IDSA) recomienda el uso de voriconazol para el tratamiento primario de la aspergilosis pulmonar invasiva, así como para otras manifestaciones, como las infecciones por aspergilosis de los senos paranasales, la aspergilosis del sistema nervioso central y la aspergilosis pulmonar necrotizante crónica.2 Si el tratamiento primario falla, se pueden usar formulaciones lipídicas de anfotericina B (AMB), caspofungina e itraconazol como terapia de rescate.2 Las directrices de la IDSA también recomiendan el uso de posaconazol como profilaxis en pacientes neutropénicos con mielodisplasia y leucemia, así como en receptores de TCMH alogénicos con enfermedad de injerto contra huésped (EICH).2
Tratamiento empírico
Voriconazol: Un ensayo aleatorizado sin enmascaramiento en el que se comparó voriconazol con AMB encontró que el 52,8% de los pacientes con voriconazol tuvieron resultados satisfactorios (resolución completa o parcial de las lesiones en radiología).16 El grupo de voriconazol también tuvo una tasa de supervivencia más alta que los pacientes con AMB (70,8% vs. 57.9%) y menos reacciones adversas (343 frente a 421; P = .02), llevando a los investigadores a concluir que voriconazol es superior al AMB.La dosis de voriconazol recomendada por las directrices de IDSA (TABLA 1) fue respaldada en este ensayo.2 Voriconazol tiene un perfil de efectos adversos que incluye sensibilidad cutánea con exposición a la luz solar directa, alteraciones visuales y hepatotoxicidad caracterizada por un aumento de la bilirrubina sérica y de las enzimas hepáticas.2
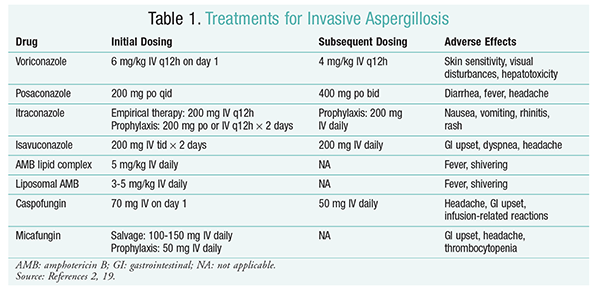
AMB: Anteriormente, el desoxicolato AMB era el estándar de atención para la aspergilosis. Sin embargo, las reacciones relacionadas con la infusión (incluyendo fiebre, rigidez, artralgias, vómitos y broncoespasmos) y la nefrotoxicidad que resulta en una posible insuficiencia renal han hecho que el AMB no sea favorecido.2 Además, puede producirse azotemia cuando se administra AMB deoxicolato junto con agentes nefrotóxicos (por ejemplo, ciclosporina o tacrolimus).2 Como resultado, el IDSA recomienda formulaciones de complejos lipídicos como alternativa, ya que la incidencia de efectos adversos es menor que la de la formulación de desoxicolato. Además, en un ensayo realizado por Walsh y colegas que comparó el complejo lipídico AMB con caspofungina, las tasas de éxito fueron similares (33,7% para AMB, 33,9% para caspofungina); por lo tanto, las directrices de tratamiento enumeran tanto el complejo lipídico AMB como la caspofungina como alternativas al voriconazol.17
Equinocandinas (Caspofungina, Micafungina, Anidulafungina): Aunque caspofungina ha sido aprobada para el tratamiento de la IA, la micafungina y la anidulafungina no han demostrado ser eficaces en el tratamiento primario de la IA y, por lo tanto, el IDSA no las recomienda.Caspofungina puede causar dolor de cabeza, trastornos gastrointestinales y posibles reacciones relacionadas con la perfusión debido a la liberación de histamina.2
Isavuconazol: En marzo de 2015, la FDA aprobó un nuevo triazol de segunda generación para IA. Comercializado con el nombre comercial Cresemba, el isavuconazol está disponible en soluciones orales e intravenosas y está indicado para el tratamiento de IA y mucormicosis.19 En una comparación de isavuconazol y voriconazol, el estudio SECURE determinó que el fármaco nuevo se comportaba de manera similar en relación con la mortalidad por cualquier causa y la respuesta global al final del tratamiento. La variable principal de mortalidad por cualquier causa en el día 42 fue del 19% para isavuconazol y del 20% para voriconazol.20 Sin embargo, se consideró que el isavuconazol no era inferior, ya que los investigadores utilizaron un margen de no inferioridad del 10% (IC -7,8 a 5,7). El isavuconazol tuvo menos reacciones adversas que el voriconazol, en particular reacciones que afectaron a los ojos, la piel y el sistema hepatobiliar.19 Finalmente, el isavuconazol tiene una alta biodisponibilidad oral, produciendo una relación 1: 1 en una conversión entre formulaciones intravenosas y orales.
Terapia de rescate
Las directrices de la IDSA no recomiendan la terapia combinada para el tratamiento inicial de IA. En su lugar, se recomienda la terapia de rescate solo si no hay respuesta clínica a la terapia inicial. En consecuencia, esto puede implicar la adición de un segundo agente o el cambio a otro medicamento. Posaconazol, itraconazol, AMB y caspofungina se han estudiado para su uso como terapia de rescate y están recomendados por las directrices de IDSA. Walsh y sus colegas investigaron la eficacia y seguridad de posaconazol 800 mg suspensión diaria en pacientes intolerantes o que no respondían al antifúngico inicial.La tasa de éxito global fue del 42% para el grupo de posaconazol y del 26% para el grupo control (P = .006).21 Un estudio de Ng y Denning demostró una tasa de respuesta del 40% cuando se utilizó una formulación de AMB basada en lípidos como terapia de rescate en pacientes con IA refractarios o intolerantes a la terapia existente.22 Caspofungina también se examinó como terapia de rescate en un estudio multicéntrico no comparativo de pacientes refractarios a la terapia convencional; se presentó una respuesta favorable en 44,6% de los pacientes.23
Profilaxis
Posaconazol: Las directrices de IDSA recomiendan el uso de posaconazol para la profilaxis de IA. Esta recomendación se basa en dos ensayos aleatorizados, controlados y multicéntricos que evaluaron el uso profiláctico de posaconazol en pacientes con neutropenia e EICH.24,25 En el primer ensayo se comparó posaconazol (3 × 200 mg/día) con fluconazol (1 × 400 mg) o itraconazol (2 × 200 mg). Se notificó IA en el 1% de los pacientes del grupo de posaconazol frente al 7% de los pacientes de los grupos de fluconazol e itraconazol (P <.001).En el segundo estudio se comparó posaconazol con fluconazol para profilaxis en pacientes con EICH. La IA fue menos frecuente en el grupo de posaconazol que en el grupo de fluconazol (1,0% vs. 5,9%; P = .001).25
Micafungina: Aunque no está aprobado para la profilaxis de primera línea de IA, las directrices de IDSA recomiendan micafungina como alternativa al posaconazol. Esta recomendación se basa en un ensayo aleatorizado, doble ciego, de fase III de 882 pacientes que recibieron micafungina 50 mg IV (1 mg/kg en pacientes <50 kg) frente a fluconazol 400 mg (8 mg/kg en pacientes <50 kg). La eficacia se definió como la ausencia de infección fúngica sistémica probada, probable o sospechada. Durante la fase neutropénica, la eficacia global de micafungina fue superior a la del fluconazol (80% para el grupo de micafungina frente a 73).5% para el grupo de fluconazol; IC 95%, 0,9-12%; P=.03).27
Conclusión
IA es una infección fúngica grave que ocurre con mayor frecuencia en pacientes inmunodeprimidos. Es necesario abordar varias preguntas en el diagnóstico, el tratamiento y la prevención de la aspergilosis. Los criterios diagnósticos están mal definidos, lo que hace difícil el diagnóstico de IA. Debido al alto riesgo de muerte, la terapia antifúngica debe iniciarse de forma rápida y correcta para que sea eficaz. Existen lagunas críticas con respecto al uso de la terapia combinada, las herramientas para la detección temprana y las poblaciones de pacientes en las que la profilaxis sería más beneficiosa.2 Por lo tanto, es importante que los farmacéuticos conozcan las características de cada agente antimicótico para estar mejor equipados para tomar decisiones terapéuticas acertadas en el tratamiento de la IA. De hecho, dado el mayor riesgo de resistencia a los antimicóticos, los farmacéuticos pueden desempeñar un papel importante en el manejo de la IA al ayudar a minimizar y manejar los efectos adversos, hacer recomendaciones de dosificación adecuadas y monitorear la selección de agentes antimicóticos adecuados, todos los cuales son críticos para optimizar el tratamiento para la IA.
1. Denning DW. Aspergilosis invasiva. Clin Infect Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergilosis: clinical practice guidelines of the Infectious Diseases Society of America (en inglés). Clin Infect Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Aspergilosis pulmonar: revisión clínica. Eur Respir Rev. 2011;20: 156-174.
4. Policía de Barnes, Marr KA. Aspergilosis: espectro de la enfermedad, diagnóstico y tratamiento. Infect Dis Clin North Am. 2006; 20: 545-561,vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. Aspergilosis invasiva en la unidad de cuidados intensivos. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. Un enfoque estadístico en el conectoma cerebral humano de la enfermedad de Parkinson en personas mayores utilizando Estadísticas Basadas en Redes. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Tasa de mortalidad por aspergilosis: revisión sistemática de la literatura. Clin Infect Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogénesis de Aspergillus fumigatus en aspergilosis invasiva. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Manifestaciones clínicas y desenlaces del tratamiento del aspergiloma pulmonar. Pasante Coreano J Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. El espectro clínico de la aspergilosis pulmonar. Tórax. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Comparison of epidemiological, clinical, and biological features of invasive aspergilosis in neutropenic and nonneutropenic patients: a 6-year survey. Clin Infect Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Inmunoanálisis enzimático de galactomanano de Aspergillus y PCR cuantitativa para el diagnóstico de aspergilosis invasiva con líquido de lavado broncoalveolar. J Clin Microbiol. 2004;42:5517-5522.
13. Wheat LJ, Walsh TJ. Diagnóstico de aspergilosis invasiva mediante detección de antigenemia por galactomanano mediante inmunoensayo enzimático. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Aspergilosis invasiva en pacientes críticamente enfermos sin neoplasias malignas. Am J Respir Crit Care Med. 2004;170:621-625.
15. Sherif R, Segal BH. Aspergilosis pulmonar: presentación clínica, pruebas diagnósticas, manejo y complicaciones. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazol versus anfotericina B para el tratamiento primario de la aspergilosis invasiva. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungina versus anfotericina B liposomal para el tratamiento antimicótico empírico en pacientes con fiebre persistente y neutropenia. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungina (FK463), sola o en combinación con otros agentes antimicóticos sistémicos, para el tratamiento de la aspergilosis invasiva aguda. J Infectar. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavuconazol: una nueva opción para el manejo de infecciones fúngicas invasivas. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazol frente a voriconazol para el tratamiento primario de la enfermedad por hongos invasivos causada por Aspergillus y otros hongos filamentosos (SECURE): un ensayo de fase 3, aleatorizado, controlado y de no inferioridad. Lanceta. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et al. Tratamiento de la aspergilosis invasiva con posaconazol en pacientes refractarios o intolerantes a la terapia convencional: ensayo controlado externamente. Clin Infect Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Tratamiento con anfotericina B liposomal (ambisoma) en infecciones fúngicas invasivas. Evaluación de los datos de uso compasivo del Reino Unido. Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Eficacia y seguridad de caspofungina para el tratamiento de la aspergilosis invasiva en pacientes refractarios o intolerantes a la terapia antifúngica convencional. Clin Infect Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Profilaxis con posaconazol frente a fluconazol o itraconazol en pacientes con neutropenia. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.