katalizátorok
a katalizátorok a mérgező molekulákat, például a szén-monoxidot és a különböző nitrogén-oxidokat ártalmatlanabb molekulákká változtatják, mint a szén-dioxid és a nitrogén. Heterogén katalizátorként drága fémeket, például platinát, palládiumot és ródiumot használnak.
a fémeket vékony rétegekben helyezik el egy kerámia méhsejtre. Ez maximalizálja a felületet, és minimálisra csökkenti a felhasznált fém mennyiségét.
a szén-monoxid és a nitrogén-monoxid közötti reakciót tipikusnak véve:
![]()
![]()
a katalizátorokat a katalizátor mérgezése befolyásolhatja. Ez akkor történik, amikor valami, ami nem része a reakciónak, nagyon erősen adszorbeálódik a katalizátor felületére, megakadályozva a normál reagensek elérését.
az ólom a katalizátorok ismert katalizátormérege. Bevonja a drága fémek méhsejtjét, és leállítja a működését.
a múltban ólomvegyületeket adtak a benzinhez (benzinhez), hogy simábban égjen a motorban. De nem használhat katalizátort, ha ólmozott üzemanyagot használ. Tehát a katalizátorok nemcsak a mérgező gázok, például a szén-monoxid és a nitrogén-oxidok eltávolítását segítették elő, hanem a mérgező ólomvegyületek eltávolítását is a benzinből.
vanádium(V) – oxid használata érintkezési eljárásban
a kénsav előállítására szolgáló érintkezési eljárás során a kén-dioxidot kén-trioxiddá kell alakítani. Ez úgy történik, hogy a kén-dioxidot és az oxigént szilárd vanádium(V) – oxid katalizátoron vezetik át.
![]()
![]()
ez a példa kissé eltér az előzőektől, mivel a gázok ténylegesen reagálnak a katalizátor felületével, ideiglenesen megváltoztatva azt. Ez egy jó példa arra, hogy az átmenetifémek és vegyületeik képesek katalizátorként működni, mivel képesek megváltoztatni oxidációs állapotukat.
a kén-dioxidot a vanádium(V) – oxid kén-trioxiddá oxidálja. A folyamat során a vanádium(V) – oxid vanádium(IV) – oxiddá redukálódik.
![]()
![]()
a vanádium (IV)-oxidot ezután az oxigén újra oxidálja.
![]()
![]()
ez jó példa arra, hogy a katalizátor hogyan változtatható meg a reakció során. A reakció végén azonban kémiailag ugyanaz lesz, mint amit elkezdett.
homogén katalízis
ennek katalizátora ugyanabban a fázisban van, mint a reagensek. Általában minden gázként vagy egyetlen folyadékfázisban lesz jelen. A példák mindegyikből egyet tartalmaznak . . .
példák a homogén katalízisre
a perszulfátionok és a jodidionok közötti reakció
ez egy olyan megoldási reakció, amelyet csak a katalízis összefüggésében találkozhat, de ez egy szép példa!
a Perszulfátionok (peroxodiszulfátionok), az S2O82-nagyon erős oxidálószerek. A jodidionok nagyon könnyen jóddá oxidálódnak. Ennek ellenére a vízben oldott reakció nagyon lassú.
ha megnézzük az egyenletet, könnyen belátható, hogy ez miért van:
![]()
![]()
a reakciónak két negatív ion ütközésére van szüksége. A visszataszítás komolyan az útjába fog kerülni!
a katalizált reakció teljesen elkerüli ezt a problémát. A katalizátor lehet vas(II) vagy vas (III) ionok, amelyeket ugyanahhoz az oldathoz adunk. Ez egy másik jó példa az átmenetifém-vegyületek katalizátorként történő alkalmazására, mivel képesek megváltoztatni az oxidációs állapotot.
az érvelés kedvéért a katalizátort vas(II) ionokká vesszük. Amint hamarosan látni fogja, valójában nem számít, hogy vas(II) vagy vas(III) ionokat használ-e.
a perszulfátionok a vas(II) – ionokat vas(III) – ionokká oxidálják. A folyamat során a perszulfátionokat szulfátionokká redukálják.
![]()
![]()
a vas (III) ionok elég erős oxidálószerek ahhoz, hogy a jodidionokat jóddá oxidálják. A folyamat során ismét vas(II) ionokká redukálódnak.
![]()
![]()
a teljes reakció mindkét szakasza pozitív és negatív ionok ütközését vonja maga után. Ez sokkal valószínűbb, hogy sikeres lesz, mint két negatív ion ütközése a katalizálatlan reakcióban.
mi történik, ha vas(III) ionokat használunk katalizátorként a vas (II) ionok helyett? A reakciók egyszerűen más sorrendben történnek.
a légköri ózon pusztulása
ez jó példa a homogén katalízisre, ahol minden gázként van jelen.
az ózon, az O3 folyamatosan képződik és újra felbomlik a magas légkörben az ultraibolya fény hatására. A közönséges oxigénmolekulák elnyelik az ultraibolya fényt, és egyes oxigénatomokra törnek. Ezek párosítatlan elektronokkal rendelkeznek, és szabad gyököknek nevezik őket. Nagyon reaktívak.
![]()

az oxigéngyökök ezután kombinálódhatnak a szokásos oxigénmolekulákkal, hogy ózont képezzenek.
![]()
![]()
az ózon az ultraibolya fény elnyelésével ismét közönséges oxigénre és oxigéngyökökre osztható.
![]()
![]()
az ózon képződése és felbomlása folyamatosan zajlik. Ezek a reakciók együttesen megakadályozzák a sok káros ultraibolya sugárzást, amely behatol a légkörbe, hogy elérje a Föld felszínét.
az általunk érdekelt katalitikus reakció elpusztítja az ózont, így megakadályozza az UV elnyelését.
a fluorozott-klórozott szénhidrogéneket (CFC-ket), például a CF2Cl2-t, széles körben használták aeroszolokban és hűtőközegként. A légkörben lassú lebomlásuk klóratomokat – klórmentes gyököket eredményez. Ezek katalizálják az ózon pusztulását.
ez két szakaszban történik. Az elsőben az ózon felbomlik, és egy új szabad gyök keletkezik.
![]()
![]()
a klórgyök katalizátort egy második reakcióval regeneráljuk. Ez kétféle módon történhet, attól függően, hogy a ClO gyök ózonmolekulát vagy oxigéngyököt érint-e.
ha eltalál egy oxigéngyököt (az egyik korábban megvizsgált reakcióból származik):
![]()
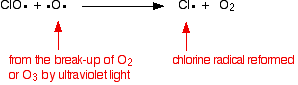
vagy ha eltalál egy ózonmolekulát:
![]()
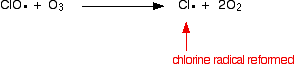
mivel a klórgyök folyamatosan regenerálódik, mindegyik ózonmolekulák ezreit képes elpusztítani.
Autokatalízis
az etándisav oxidációja manganát(VII) ionokkal
autokatalízisben a reakciót az egyik terméke katalizálja. Ennek egyik legegyszerűbb példája az etándisav (oxálsav) oldatának oxidációja kálium-manganát(VII) (kálium-permanganát) savanyított oldatával.
![]()
![]()
a reakció szobahőmérsékleten nagyon lassú. Titrálásként használják a kálium-manganát(VII) oldat koncentrációjának meghatározására, és általában körülbelül 60cc hőmérsékleten hajtják végre.
a reakciót mangán(II) ionok katalizálják. Nyilvánvalóan nincsenek jelen a reakció kezdete előtt, ezért szobahőmérsékleten rendkívül lassan indul. Ha azonban megnézzük az egyenletet, mangán(II) ionokat találunk a termékek között. A reakció előrehaladtával egyre több katalizátor keletkezik, így a reakció felgyorsul.
ezt a hatást úgy mérheti, hogy az egyik reagens koncentrációját ábrázolja az idő múlásával. Kapsz egy grafikont, amely teljesen eltér a reakció normál sebességgörbéjétől.
a legtöbb reakció sebességgörbét ad, amely így néz ki:
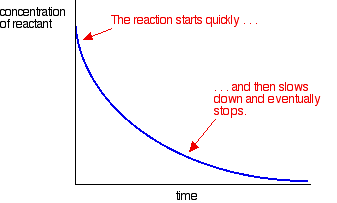
a koncentráció kezdetben magas, ezért a reakció gyors – a reagens koncentrációjának gyors csökkenése mutatja. Ahogy a dolgok elhasználódnak, a reakció lelassul, és végül leáll, mivel egy vagy több reagens teljesen elhasználódik.
az autokatalízis egy példája ilyen görbét ad:
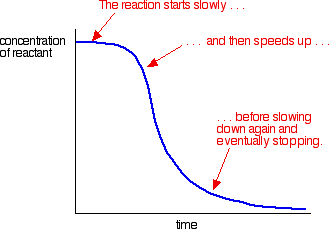
láthatjuk a lassú (uncatalysed) reakció elején. Ahogy a katalizátor kezd kialakulni a keverékben, a reakció felgyorsul – egyre gyorsabbá válik, ahogy egyre több katalizátor képződik. Végül is, természetesen, az arány ismét csökken, ahogy a dolgok elhasználódnak.
figyelem!
ne feltételezzük, hogy egy ilyen sebességgörbe szükségszerűen az autokatalízis példáját mutatja. Vannak más hatások is, amelyek hasonló grafikont eredményezhetnek.
például, ha a reakció során egy szilárd anyag reakcióba lép egy folyadékkal, akkor a szilárd anyagon valamilyen felületi bevonat lehet, amelyen a folyadéknak át kell hatolnia, mielőtt a várt reakció bekövetkezhet.
egy gyakoribb lehetőség az, hogy erősen exoterm reakciónk van, és nem szabályozzuk megfelelően a hőmérsékletet. A reakció során kialakult hő felgyorsítja a reakciót.