Katalysatorer
Katalysatorer endrer giftige molekyler som karbonmonoksid og forskjellige nitrogenoksider i bilutslipp til mer ufarlige molekyler som karbondioksid og nitrogen. De bruker dyre metaller som platina, palladium og rhodium som heterogen katalysator.
metallene avsettes som tynne lag på en keramisk honeycomb. Dette maksimerer overflaten og holder mengden metall som brukes til et minimum.
Tar reaksjonen mellom karbonmonoksid og nitrogenmonoksid som typisk:
![]()
![]()
Katalysatorer kan påvirkes av katalysatorforgiftning. Dette skjer når noe som ikke er en del av reaksjonen blir veldig sterkt adsorbert på overflaten av katalysatoren, og forhindrer at de normale reaktantene når den.
Bly er en kjent katalysatorgift for katalysatorer. Den dekker honeycomb av dyre metaller og stopper det å fungere.
tidligere ble blyforbindelser tilsatt bensin (bensin) for å få det til å brenne mer jevnt i motoren. Men du kan ikke bruke en katalysator hvis du bruker blyholdig drivstoff. Så katalysatorer har ikke bare bidratt til å fjerne giftige gasser som karbonmonoksid og nitrogenoksider, men har også tvunget fjerning av giftige blyforbindelser fra bensin.
bruk av vanadium (V) oksid I Kontaktprosessen
under Kontaktprosessen for produksjon av svovelsyre, svoveldioksid må omdannes til svoveltrioksid. Dette gjøres ved å sende svoveldioksid og oksygen over en solid vanadium (V) oksydkatalysator.
![]()
![]()
dette eksemplet er litt forskjellig fra de forrige fordi gassene faktisk reagerer med overflaten av katalysatoren, midlertidig endrer den. Det er et godt eksempel på evnen til overgangsmetaller og deres forbindelser til å fungere som katalysatorer på grunn av deres evne til å endre oksidasjonstilstanden.
svoveldioksidet oksideres til svoveltrioksid av vanadium (V) oksydet. I prosessen reduseres vanadium(V) oksydet til vanadium (IV) oksid.
![]()
![]()
vanadium (IV) oksydet blir deretter reoksidert av oksygen.
![]()
![]()
dette er et godt eksempel på hvordan en katalysator kan endres i løpet av en reaksjon. På slutten av reaksjonen vil det imidlertid være kjemisk det samme som det startet.
Homogen katalyse
dette har katalysatoren i samme fase som reaktantene. Vanligvis vil alt være til stede som en gass eller inneholdt i en enkelt væskefase. Eksemplene inneholder en av hver av disse . . .
eksempler på homogen katalyse
reaksjonen mellom persulfationer og jodidioner
dette er en løsningsreaksjon som du kanskje bare møter i sammenheng med katalyse, men det er et herlig eksempel!
Persulfationer (peroksodisulfationer), S2O82-, er svært kraftige oksidasjonsmidler. Jodidioner oksyderes veldig lett til jod. Og likevel er reaksjonen mellom dem i oppløsning i vann veldig sakte.
hvis du ser på ligningen, er det lett å se hvorfor det er:
![]()
![]()
reaksjonen trenger en kollisjon mellom to negative ioner. Frastøtelse kommer til å bli alvorlig i veien for det!
den katalyserte reaksjonen unngår dette problemet helt. Katalysatoren kan være enten jern(II) eller jern (III) ioner som tilsettes til den samme løsningen. Dette er et annet godt eksempel på bruk av overgangsmetallforbindelser som katalysatorer på grunn av deres evne til å endre oksidasjonstilstand.
for argumentets skyld tar vi katalysatoren til å være jern(II) ioner. Som du vil se snart, spiller det ingen rolle om du bruker jern(II) eller jern (III) ioner.
persulfationene oksiderer jern(II) ioner til jern(III) ioner. I prosessen blir persulfationer redusert til sulfationer.
![]()
![]()
jern (III) ioner er sterke nok oksidasjonsmidler til å oksidere jodidioner til jod. I prosessen blir de redusert tilbake til jern (II) ioner igjen.
![]()
![]()
Begge disse individuelle stadiene i den samlede reaksjonen involverer kollisjon mellom positive og negative ioner. Dette vil være mye mer sannsynlig å lykkes enn kollisjon mellom to negative ioner i uncatalysed reaksjonen.
hva skjer hvis du bruker jern(III) ioner som katalysator i stedet for jern(II) ioner? Reaksjonene skjer ganske enkelt i en annen rekkefølge.
ødeleggelsen av atmosfærisk ozon
dette er et godt eksempel på homogen katalyse hvor alt er til stede som en gass.
Ozon, O3, blir stadig dannet og brutt opp igjen i den høye atmosfæren ved hjelp av ultrafiolett lys. Vanlige oksygenmolekyler absorberer ultrafiolett lys og bryter inn i individuelle oksygenatomer. Disse har uparede elektroner, og er kjent som frie radikaler. De er veldig reaktive.
![]()

oksygenradikalene kan deretter kombineres med vanlige oksygenmolekyler for å lage ozon.
![]()
![]()
Ozon kan også deles opp igjen i vanlig oksygen og et oksygenradikal ved å absorbere ultrafiolett lys.
![]()
![]()
denne dannelsen og nedbrytingen av ozon skjer hele tiden. Til sammen stopper disse reaksjonene mye skadelig ultrafiolett stråling som trenger inn i atmosfæren for å nå jordens overflate.
den katalytiske reaksjonen vi er interessert i ødelegger ozonet og stopper dermed uv-absorberingen på DENNE måten.
Klorfluorkarboner (Kfk) som CF2Cl2, for eksempel, ble brukt mye i aerosoler og som kjølemidler. Deres langsomme sammenbrudd i atmosfæren produserer kloratomer-klorfrie radikaler. Disse katalyserer ødeleggelsen av ozon.
dette skjer i to trinn. I det første brytes ozonet opp og et nytt frie radikaler produseres.
![]()
![]()
klorradikalkatalysatoren regenereres ved en andre reaksjon. Dette kan skje på to måter avhengig av Om clo-radikalet treffer et ozonmolekyl eller et oksygenradikal.
hvis den treffer et oksygenradikal (produsert fra en av reaksjonene vi har sett på tidligere):
![]()
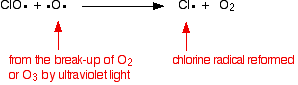
eller hvis det treffer et ozonmolekyl:
![]()
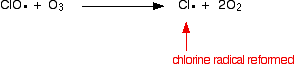
fordi klorradikalet fortsetter å bli regenerert, kan hver enkelt ødelegge tusenvis av ozonmolekyler.
Autokatalyse
oksidasjonen av etandisyre ved manganat (VII) ioner
i autokatalyse katalyseres reaksjonen av en av sine produkter. Et av de enkleste eksemplene på dette er oksydasjon av en løsning av etandisyre (oksalsyre) ved en surgjort løsning av kaliummanganat (VII) (kaliumpermanganat).
![]()
![]()
reaksjonen er svært langsom ved romtemperatur. Det brukes som en titrering for å finne konsentrasjonen av kalium manganat (VII) løsning og utføres vanligvis ved en temperatur på ca 60°C. Likevel er det ganske sakte å begynne med.
reaksjonen katalyseres av mangan(II) ioner. Det er åpenbart ikke noen av de som er tilstede før reaksjonen starter, og så starter den ekstremt sakte ved romtemperatur. Men hvis du ser på ligningen, finner du mangan (II) ioner blant produktene. Mer og mer katalysator produseres når reaksjonen fortsetter,og så øker reaksjonen.
du kan måle denne effekten ved å plotte konsentrasjonen av en av reaktantene etter hvert som tiden går. Du får en graf ganske ulikt den normale kurve for en reaksjon.
de fleste reaksjoner gir en kurve som ser slik ut:
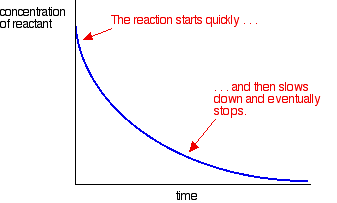
Konsentrasjonene er høye i begynnelsen, og så reaksjonen er rask-vist ved et raskt fall i reaktantkonsentrasjonen. Som ting blir brukt opp, reaksjonen bremser ned og til slutt stopper som en eller flere av reaktantene er helt brukt opp.
et eksempel på autokatalyse gir en kurve som dette:
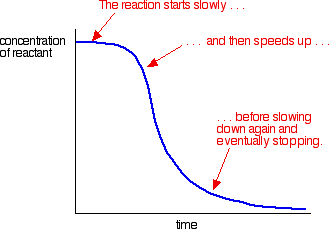
du kan se den langsomme (uncatalysed) reaksjonen i begynnelsen. Når katalysator begynner å bli dannet i blandingen, øker reaksjonen raskere og raskere etter hvert som flere og flere katalysatorer dannes. Til slutt, selvfølgelig, faller frekvensen igjen som ting blir brukt opp.
Advarsel!
ikke anta at en kurve som ser slik ut, nødvendigvis viser et eksempel på autokatalyse. Det er andre effekter som kan produsere en lignende graf.
for eksempel, hvis reaksjonen involverte et fast stoff som reagerer med en væske, kan det være en slags overflatebelegg på det faste stoffet som væsken må trenge inn før den forventede reaksjonen kan skje.
en mer vanlig mulighet er at du har en sterkt eksoterm reaksjon og ikke kontrollerer temperaturen riktig. Varmen utviklet seg under reaksjonen hastigheter reaksjonen opp.