Convertidores catalíticos
Los convertidores catalíticos cambian las moléculas venenosas como el monóxido de carbono y varios óxidos de nitrógeno en los escapes de automóviles en moléculas más inofensivas como el dióxido de carbono y el nitrógeno. Utilizan metales caros como platino, paladio y rodio como catalizador heterogéneo.
Los metales se depositan en capas finas sobre un panal de cerámica. Esto maximiza el área de superficie y mantiene la cantidad de metal utilizada al mínimo.
Tomar la reacción entre el monóxido de carbono y el monóxido de nitrógeno como típica:
![]()
![]()
Los convertidores catalíticos pueden verse afectados por envenenamiento por catalizador. Esto sucede cuando algo que no es parte de la reacción se adsorbe muy fuertemente en la superficie del catalizador, evitando que los reactivos normales lleguen a él.
El plomo es un veneno catalizador conocido para convertidores catalíticos. Recubre el panal de metales caros y deja de funcionar.
En el pasado, se agregaban compuestos de plomo a la gasolina para que se quemara más suavemente en el motor. Pero no se puede usar un convertidor catalítico si se utiliza combustible con plomo. Por lo tanto, los convertidores catalíticos no solo han ayudado a eliminar gases venenosos como el monóxido de carbono y los óxidos de nitrógeno, sino que también han forzado la eliminación de compuestos venenosos de plomo de la gasolina.
El uso de óxido de vanadio(V) en el Proceso de contacto
Durante el Proceso de contacto para la fabricación de ácido sulfúrico, el dióxido de azufre debe convertirse en trióxido de azufre. Esto se hace pasando dióxido de azufre y oxígeno sobre un catalizador de óxido de vanadio sólido(V).
![]()
![]()
Este ejemplo es ligeramente diferente de los anteriores porque los gases realmente reaccionan con la superficie del catalizador, cambiándola temporalmente. Es un buen ejemplo de la capacidad de los metales de transición y sus compuestos para actuar como catalizadores debido a su capacidad para cambiar su estado de oxidación.
El dióxido de azufre es oxidado a trióxido de azufre por el óxido de vanadio (V). En el proceso, el óxido de vanadio (V) se reduce a óxido de vanadio(IV).
![]()
![]()
El óxido de vanadio(IV) es entonces re-oxidado por el oxígeno.
![]()
![]()
Este es un buen ejemplo de la forma en que se puede cambiar un catalizador durante el curso de una reacción. Al final de la reacción, sin embargo, será químicamente el mismo que comenzó.
Catálisis homogénea
Tiene el catalizador en la misma fase que los reactivos. Por lo general, todo estará presente como un gas o contenido en una sola fase líquida. Los ejemplos contienen uno de cada uno de ellos . . .
Ejemplos de catálisis homogénea
La reacción entre iones persulfato e iones yoduro
Esta es una reacción de solución que puede encontrarse solo en el contexto de la catálisis, ¡pero es un hermoso ejemplo!
Los iones persulfato (iones peroxodisulfato), S2O82-, son agentes oxidantes muy potentes. Los iones yoduro se oxidan muy fácilmente a yodo. Y sin embargo, la reacción entre ellos en solución en agua es muy lenta.
Si nos fijamos en la ecuación, es fácil ver por qué es:
![]()
![]()
La reacción necesita una colisión entre dos iones negativos. ¡La repulsión se va a poner seriamente en el camino de eso!
La reacción catalizada evita ese problema por completo. El catalizador puede ser iones de hierro(II) o hierro(III) que se añaden a la misma solución. Este es otro buen ejemplo del uso de compuestos metálicos de transición como catalizadores debido a su capacidad para cambiar el estado de oxidación.
En aras de la argumentación, tomaremos el catalizador como iones de hierro(II). Como verá en breve, en realidad no importa si usa iones de hierro(II) o hierro(III).
Los iones persulfato oxidan los iones de hierro(II) a iones de hierro(III). En el proceso, los iones persulfato se reducen a iones sulfato.
![]()
![]()
Los iones hierro (III) son agentes oxidantes lo suficientemente fuertes como para oxidar iones yoduro en yodo. En el proceso, se reducen de nuevo a iones de hierro(II).
![]()
![]()
Ambas etapas individuales de la reacción general implican una colisión entre iones positivos y negativos. Esto será mucho más probable que tenga éxito que la colisión entre dos iones negativos en la reacción sin catalizar.
¿Qué sucede si utiliza iones de hierro (III) como catalizador en lugar de iones de hierro(II)? Las reacciones simplemente ocurren en un orden diferente.
La destrucción del ozono atmosférico
Este es un buen ejemplo de catálisis homogénea donde todo está presente como un gas.
El ozono, O3, se forma y se rompe de nuevo constantemente en la alta atmósfera por la acción de la luz ultravioleta. Las moléculas de oxígeno ordinarias absorben la luz ultravioleta y se rompen en átomos de oxígeno individuales. Estos tienen electrones no emparejados, y se conocen como radicales libres. Son muy reactivos.
![]()

Los radicales de oxígeno pueden combinarse con moléculas de oxígeno comunes para producir ozono.
![]()
![]()
El ozono también se puede dividir de nuevo en oxígeno ordinario y un radical de oxígeno absorbiendo luz ultravioleta.
![]()
![]()
Esta formación y ruptura de ozono ocurre todo el tiempo. En conjunto, estas reacciones detienen una gran cantidad de radiación ultravioleta dañina que penetra en la atmósfera para llegar a la superficie de la Tierra.
La reacción catalítica que nos interesa destruye el ozono y, por lo tanto, evita que absorba los rayos UV de esta manera.
Los clorofluorocarbonos (CFC), como el CF2Cl2, por ejemplo, se utilizaron ampliamente en aerosoles y como refrigerantes. Su descomposición lenta en la atmósfera produce átomos de cloro, radicales libres de cloro. Estos catalizan la destrucción del ozono.
Esto sucede en dos etapas. En la primera, se rompe el ozono y se produce un nuevo radical libre.
![]()
![]()
El catalizador radical de cloro se regenera mediante una segunda reacción. Esto puede ocurrir de dos maneras, dependiendo de si el radical ClO golpea una molécula de ozono o un radical de oxígeno.
Si golpea un radical de oxígeno (producido a partir de una de las reacciones que hemos visto anteriormente):
![]()
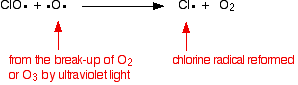
O si golpea una molécula de ozono:
![]()
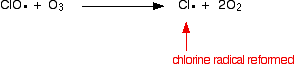
Debido a que el radical de cloro se sigue regenerando, cada uno puede destruir miles de moléculas de ozono.
Autocatálisis
La oxidación del ácido etanodioico por iones de manganato(VII)
En autocatálisis, la reacción es catalizada por uno de sus productos. Uno de los ejemplos más simples de esto es la oxidación de una solución de ácido etanodioico (ácido oxálico) por una solución acidificada de manganato de potasio(VII) (permanganato de potasio).
![]()
![]()
La reacción es muy lenta a temperatura ambiente. Se utiliza como valoración para encontrar la concentración de solución de manganato de potasio(VII) y generalmente se lleva a cabo a una temperatura de aproximadamente 60°C. Aún así, es bastante lento para comenzar.
La reacción es catalizada por iones de manganeso(II). Obviamente, no hay ninguno de esos presentes antes de que comience la reacción, por lo que comienza extremadamente lentamente a temperatura ambiente. Sin embargo, si nos fijamos en la ecuación, encontrará iones de manganeso(II) entre los productos. Se produce más y más catalizador a medida que la reacción avanza y, por lo tanto, la reacción se acelera.
Puede medir este efecto trazando la concentración de uno de los reactivos a medida que pasa el tiempo. Se obtiene un gráfico bastante diferente de la curva de velocidad normal para una reacción.
La mayoría de las reacciones dan una curva de velocidad que se ve así:
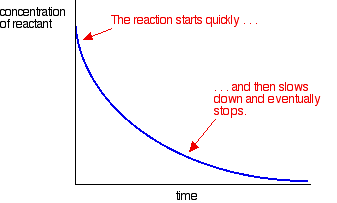
Las concentraciones son altas al principio y, por lo tanto, la reacción es rápida, lo que se demuestra por una caída rápida de la concentración del reactivo. A medida que las cosas se acostumbran, la reacción se ralentiza y finalmente se detiene cuando uno o más de los reactivos se agotan por completo.
Un ejemplo de autocatálisis da una curva como esta:
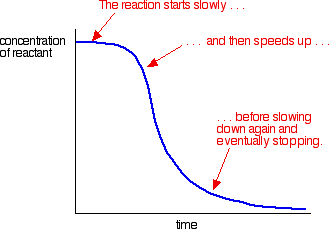
Puede ver la reacción lenta (sin catalizar) al principio. A medida que el catalizador comienza a formarse en la mezcla, la reacción se acelera, cada vez más rápido a medida que se forma más y más catalizador. Con el tiempo, por supuesto, la tasa cae de nuevo a medida que las cosas se agotan.
¡Atención!
No asuma que una curva de velocidad que se parece a esta muestra necesariamente un ejemplo de autocatálisis. Hay otros efectos que podrían producir un gráfico similar.
Por ejemplo, si la reacción involucró un sólido que reacciona con un líquido, puede haber algún tipo de revestimiento superficial en el sólido que el líquido tiene que penetrar antes de que pueda ocurrir la reacción esperada.
Una posibilidad más común es que tenga una reacción fuertemente exotérmica y no controle la temperatura adecuadamente. El calor evolucionado durante la reacción acelera la reacción.