US Pharm. 2016; 41 (4): HS15-HS20.
sammanfattning: invasiv aspergillos (IA) är en sällsynt, allvarlig svampinfektion som vanligtvis påverkar immunkompromitterade patienter. Den exakta förekomsten av IA har inte dokumenterats och rapporterade incidensnivåer varierar mycket. Några typiska riskfaktorer för IA inkluderar hematopoietiska stamcellstransplantationer, långvarig kortikosteroidbehandling, hematologiska maligniteter och HIV. Lungorna är den vanligaste platsen för IA; följaktligen är symtom och kliniska manifestationer vanligtvis lung. På grund av den höga risken för dödsfall måste IA-hantering med lämpliga agenter påbörjas så snabbt som möjligt. Vorikonazol är den första linjens empiriska terapi som rekommenderas av Infectious Diseases Society of America riktlinjer; om det inte finns något kliniskt svar, bör räddningsterapi med andra azoler, echinocandiner eller amfotericin B lipidformuleringar administreras.
aspergillos är en svampinfektion orsakad av Aspergillus, som omfattar en stor grupp av allestädes närvarande mögelarter (spp) som oftast finns i nedbrytande vegetation.1 aspergillos, som oftast observeras hos personer med nedsatt immunförsvar, är en betydande orsak till sjuklighet och dödlighet i denna befolkning, med dödlighet så hög som 90%.2,3 det finns flera typer av aspergillosinfektioner, inklusive allergisk bronkopulmonell aspergillos, allergisk Aspergillus bihåleinflammation, aspergillom, kronisk pulmonell aspergillos, kutan aspergillos och invasiv aspergillos (IA). De flesta av dessa infektioner orsakas av Aspergillus fumigatus, följt av Aspergillus flavus, Aspergillus niger och Aspergillus terreus.4-6 IA är i synnerhet en av de allvarligaste aspergillosinfektionerna, och den har en hög dödlighet.5
etiologi och epidemiologi
vanliga riskfaktorer för IA inkluderar hematopoietisk stamcellstransplantation (HSCT), långvarig och svår neutropeni, hematologiska maligniteter, långvarig kortikosteroidbehandling och HIV. Vissa ICU-immunkompetenta populationer, såsom patienter med kronisk obstruktiv lungsjukdom, svår leversjukdom eller kritiska sjukdomar som tillfälligt stör immunsystemet, har också ökad risk för IA.5 förekomsten av IA i en typisk ICU rapporteras vara 0,33% till 6,9%, vilket är jämförbart med förekomsten hos patienter med fast organtransplantation.4,5
aspergillos är inte en rapporterbar infektion i USA eftersom det är ovanligt och inte anses vara ett allvarligt hot mot folkhälsan.6 som ett resultat har den exakta förekomsten av IA inte dokumenterats. Dessutom kan rapporterade incidensnivåer variera väsentligt, vilket tyder på att geografi kan spela en roll.4 bland transplantatmottagare varierar förekomsten av IA, med vanliga underliggande tillstånd inklusive lymfom och leukemi.7 bland mottagare av fast organtransplantation är förekomsten av IA högre hos lung – och levertransplanterade mottagare (2,4% -6% respektive 1% -8%) än hos njur-och hjärttransplanterade mottagare (0,1% -4% respektive 0,3% -6%).4 förekomsten av IA hos HSCT-mottagare är ännu högre. Allogena HSCT-mottagare har en IA-förekomst på 2,3% till 11%, vilket är mer än dubbelt så mycket som den observerade incidensen hos autologa HSCT-mottagare (0,5% -4%).4 den totala dödsfallet har beräknats till 58%.7,8 fall-dödsfall av IA varierar emellertid beroende på det underliggande tillståndet. I en systematisk genomgång av 53 studier från 1995 till 1999 var falldödligheten hos IA-patienter högst hos patienter med en historia av benmärgstransplantationer (86, 7%) eller HIV/AIDS (85, 7%) och lägst hos patienter med leukemi eller lymfom (49, 3%).7
patogenes
efter inandning av en fumigatus conidia (luftburna sporer) utlöser respiratoriska epitelceller och alveolära makrofager medfödda immunsvar mot inhalerad Aspergillus conidia. Dessa patogener känner sedan igen receptorer på värdceller, såsom beta-glukanreceptorn Dectin-1. Interaktionen mellan patogener och receptorer provocerar kemokiner och cytokiner och aktiverar och rekryterar monocyter och neutrofiler. Neutrofiler fäster vid svamphyfer och degranulerar, vilket resulterar i svampdödande. Denna attack medieras av nikotinamidadenindinukleotidfosfatoxidas. När det gäller neutropeni är neutrofiler inte tillgängliga för hyphaldödande och kontroll av svamptillväxt, så växande hyfer kan sedan spridas genom endotelcellens foder.8
kliniska manifestationer
lungorna är den vanligaste platsen för IA. Följaktligen är IA-symtom och kliniska manifestationer vanligtvis lung. I en studie observerade Lee och kollegor IA-symtom hos 36 patienter och fann att hemoptys var den vanligaste kliniska manifestationen (72%), följt av hosta, andnöd och trötthet.9 utredarna noterade att ia-symtom varierade från asymptomatisk till massiv hemoptys (ibland dödlig), och graden av symtomdebut varierade baserat på patientens immunsystem. Patienter med viss grad av immunsuppression (t. ex. Diabetes mellitus, alkoholism) kan uppvisa snabbare utveckling av symtom (dvs veckor snarare än månader).10 i en 6-årig undersökning utförd av Cornillet och kollegor var feber det vanligaste kliniska tecknet hos IA-patienter, som presenterades hos 85% av patienterna (n = 88); bröstsmärta var också vanligt.11 ytterligare symtom inkluderar viktminskning, svettningar och anorexi.10
diagnos
odling av vävnad är för närvarande guldstandarden för diagnos av IA.11 denna metod ger inte bara Aspergillus spp, men definierar vidare terapeutiska alternativ via känslighetstestning. Emellertid gör invasiviteten att erhålla vävnad odling mindre önskvärt. I frånvaro av vävnadsprover kan bronchoalveolär sköljning (BAL) vätska erhållen från övre och nedre luftvägarna tjäna till att fastställa diagnosen IA.12 Även om BAL är ett säkert förfarande är den totala känsligheten för odling med BAL-prover relativt låg (uppskattad till 50%).13 blodprovtagning är det optimala icke-invasiva diagnostiska tillvägagångssättet för IA.12 trots denna icke-invasivitet isoleras emellertid Aspergillus spp sällan från blod genom konventionella odlingstekniker-därmed beroendet av vävnadsprover för att säkra en definitiv diagnos av IA.12 eftersom resultaten från kulturer är relativt långsamma för att få övergripande, är IA väl etablerad när kulturen är positiv. Dessa utmaningar har resulterat i utvecklingen av diagnostiska metoder som är mindre invasiva och snabbare.
serumgalaktomannan-analysen är ett snabbtest som är godkänt för att diagnostisera misstänkta fall av IA hos patienter med hematologiska maligniteter eller HSCTs.13 galaktomannan, en polysackarid som frigörs i kroppsvätskor under Aspergillus-tillväxt, kan detekteras i serum-och BAL-prover flera dagar innan kliniska tecken och symtom uppträder.13 Serumdetektering kan underlätta upprättandet av en specifik diagnos, medan BAL-vätska verkar ha en högre känslighet men ofta är svårare att få.12,13 Meersseman och kollegor rapporterade känsligheten för galaktomannan detektion vara 88% för BAL kontra 42% för serum, och specificiteten av galaktomannan för både BAL och serum var 86%.14 ett positivt serumresultat kan möjliggöra initiering av svampdödande medel, medan ett negativt resultat potentiellt kan förhindra användning av dyra och giftiga svampdödande läkemedel.12 mätning av (1,3)-beta-D-glukan i blodet kan också vara användbart som ett screeningsverktyg för IA. Även om galaktomannan-analysen är specifik för IA, kan (1,3)-beta-D-glukan-analysen också upptäcka andra invasiva svampsjukdomar, inklusive candidiasis, andra mögelpatogener och Pneumocystis jiroveci.15
hantering
antimykotisk behandling förblir grunden för behandling av IA.2 för att förhindra komplikationer och dåliga resultat bör antimykotisk behandling initieras omedelbart hos patienter med hög risk för IA.2 Infectious Diseases Society of America (IDSA) rekommenderar användning av voriconazol för primär behandling av invasiv pulmonell aspergillos, liksom för andra manifestationer, såsom aspergillosinfektioner i bihålorna, aspergillos i centrala nervsystemet och kronisk nekrotiserande lungaspergillos.2 om primär behandling misslyckas kan lipidformuleringar av amfotericin B (AMB), caspofungin och itrakonazol användas som räddningsterapi.2 IDSA-riktlinjerna rekommenderar också användning av posakonazol för profylax hos neutropeniska patienter med myelodysplasi och leukemi, liksom hos allogena HSCT-mottagare med graft-versus-host-sjukdom (GvHD).2
empirisk behandling
vorikonazol: en randomiserad, icke-blindad studie som jämförde vorikonazol med AMB fann att 52, 8% av vorikonazolpatienterna upplevde framgångsrika resultat (fullständig eller partiell upplösning av lesioner på radiologi).16 vorikonazolgruppen hade också en högre överlevnadsgrad än AMB-patienter (70,8% mot 57.9%) och färre biverkningar (343 händelser mot 421 händelser; P = .02), ledande utredare att dra slutsatsen att voriconazol är överlägsen AMB.16 vorikonazoldosen som rekommenderas av IDSA-riktlinjerna (tabell 1) stöddes i denna studie.2 vorikonazol har en biverkningsprofil som inkluderar hudkänslighet med exponering för direkt solljus, synstörningar och hepatotoxicitet som kännetecknas av en ökning av serumbilirubin och leverenzymer.2
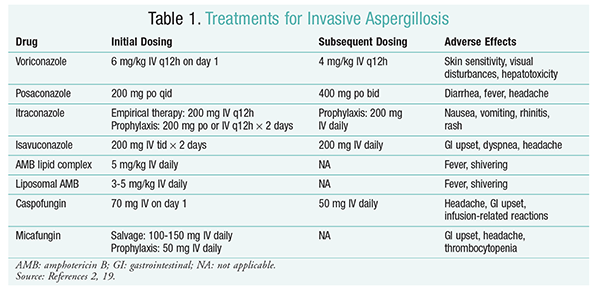
AMB: tidigare var AMB-deoxikolat vårdstandarden för aspergillos. Infusionsrelaterade reaktioner (inklusive feber, stelhet, artralgi, kräkningar och bronkospasmer) och nefrotoxicitet som resulterar i potentiellt njursvikt har dock orsakat AMB att falla i onåd.2 dessutom kan azotemi uppträda när AMB-DEOXIKOLAT ges samtidigt med nefrotoxiska medel (t.ex. cyklosporin eller takrolimus).2 som ett resultat rekommenderar IDSA lipidkomplexformuleringar som ett alternativ, eftersom förekomsten av biverkningar är lägre än för deoxikolatformuleringen. I en studie av Walsh och kollegor som jämförde amb-lipidkomplex med kaspofungin var framgångsgraden likartade (33, 7% för AMB, 33, 9% för kaspofungin); därför listar behandlingsriktlinjerna både AMB-lipidkomplex och kaspofungin som alternativ till vorikonazol.17
Echinocandiner (Caspofungin, Micafungin, Anidulafungin): även om caspofungin har godkänts för IA-behandling, har micafungin och anidulafungin inte visat sig vara effektiva vid den primära behandlingen av IA och rekommenderas därför inte av IDSA.18 Kaspofungin kan orsaka huvudvärk, gastrointestinala störningar och möjliga infusionsrelaterade reaktioner på grund av histaminfrisättning.2
Isavukonazol: i mars 2015 godkände FDA en ny andra generationens triazol för IA. Isavukonazol marknadsförs under handelsnamnet Cresemba och finns i både orala och IV-lösningar och är indicerat för behandling av IA och mukormykos.19 i en jämförelse mellan isavukonazol och vorikonazol fastställde SECURE-studien att det nya medlet presterade på samma sätt med avseende på mortalitet av alla orsaker och övergripande svar vid slutet av behandlingen. Det primära effektmåttet för mortalitet av alla orsaker dag 42 var 19% för isavukonazol och 20% för vorikonazol.20 isavukonazol ansågs dock vara icke-underlägsen eftersom utredarna använde en 10% icke-underlägsenhetsmarginal (CI -7, 8 till 5, 7). Isavukonazol hade färre biverkningar än vorikonazol, särskilt händelser som involverade ögon, hud och hepatobiliära system.19 Slutligen har isavukonazol hög oral biotillgänglighet, vilket ger ett förhållande 1: 1 i en omvandling mellan IV och orala formuleringar.
Salvage Therapy
IDSA-riktlinjerna rekommenderar inte kombinationsbehandling för initial behandling av IA. Istället rekommenderas räddningsterapi endast om det inte finns något kliniskt svar på initial terapi. Följaktligen kan detta innebära att man lägger till ett andra medel eller byter till ett annat läkemedel. Posakonazol, itrakonazol, AMB och kaspofungin har studerats för användning som räddningsterapi och rekommenderas av IDSA-riktlinjer. Walsh och kollegor undersökte effekten och säkerheten av posakonazol 800 mg suspension dagligen hos patienter som var intoleranta eller inte svarade på det initiala antimykotiska medlet.21 Den totala framgångsgraden var 42% för posakonazolgruppen och 26% för kontrollgruppen (P = .006).21 En studie av Ng och Denning visade en svarsfrekvens på 40% när en lipidbaserad formulering av AMB användes som räddningsterapi hos IA-patienter som var eldfasta eller intoleranta mot befintlig terapi.22 Caspofungin undersöktes också som räddningsterapi i en icke-jämförande multicenterstudie av patienter som var eldfasta mot konventionell terapi; ett gynnsamt svar inträffade hos 44,6% av patienterna.23
profylax
posakonazol: IDSA-riktlinjerna rekommenderar användning av posakonazol för profylax av IA. Denna rekommendation är baserad på två randomiserade, kontrollerade multicenterstudier som utvärderade profylaktisk användning av posakonazol hos patienter med neutropeni och GvHD.24,25 i den första studien jämfördes posakonazol (3 200 mg 200 mg/dag) med flukonazol (1 400 mg 400 mg) eller itrakonazol (2 200 mg 200 mg). IA rapporterades hos 1% av patienterna i posakonazolgruppen jämfört med 7% av patienterna i flukonazol-och itrakonazolgrupperna (P <.001).26 i den andra studien jämfördes posakonazol med flukonazol för profylax hos patienter med GvHD. IA var mindre frekvent i posakonazolgruppen än i flukonazolgruppen (1,0% mot 5,9%; P = .001).25
Micafungin: Även om det inte är godkänt för förstahandsprofylax av IA, rekommenderar IDSA-riktlinjerna micafungin som ett alternativ till posakonazol. Denna rekommendation är baserad på en randomiserad, dubbelblind fas III-studie med 882 patienter som fick micafungin 50 mg IV (1 mg/kg hos patienter <50 kg) jämfört med flukonazol 400 mg (8 mg/kg hos patienter <50 kg). Effekten definierades som frånvaro av bevisad, sannolik eller misstänkt systemisk svampinfektion. Under den neutropeniska fasen var den totala effekten av micafungin överlägsen den för flukonazol (80% för micafungin-gruppen vs. 73.5% för flukonazolgruppen; 95% ki, 0,9% -12%; P = .03).27
slutsats
IA är en allvarlig svampinfektion som förekommer oftast hos patienter med nedsatt immunförsvar. Flera frågor måste behandlas vid diagnos, behandling och förebyggande av aspergillos. Diagnostiska kriterier är dåligt definierade, vilket gör diagnosen IA utmanande. På grund av den höga risken för dödsfall måste antimykotisk behandling initieras snabbt och korrekt för att vara effektiv. Kritiska luckor finns när det gäller användning av kombinationsterapi, verktyg för tidig upptäckt och de patientpopulationer i vilka profylax skulle vara mest fördelaktig.2 Därför är det viktigt för apotekare att vara kunniga om varje svampdödande medels egenskaper för att vara bäst utrustade för att fatta sunda terapeutiska beslut vid behandling av IA. Med tanke på den ökade risken för svampdödande resistens kan apotekare spela en viktig roll i hanteringen av IA genom att hjälpa till med minimering och hantering av biverkningar, göra lämpliga doseringsrekommendationer och övervaka valet av lämpliga antifungala medel—som alla är kritiska för att optimera terapi för IA.
1. Denning DW. Invasiv aspergillos. Clin Infektera Dis. 1998;26:781-803.
2. Han är en av de mest kända. Behandling av aspergillos: riktlinjer för klinisk praxis från Infectious Diseases Society of America. Clin Infektera Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Pulmonell aspergillos: en klinisk granskning. Eur Respir Rev. 2011; 20: 156-174.
4. Barnes PD, Marr KA. Aspergillos: spektrum av sjukdom, diagnos och behandling. Infektera Dis Clin Norr Am. 2006; 20:545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. invasiv aspergillos i intensivvården. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. Ett statistiskt tillvägagångssätt i mänsklig hjärnanslutning av Parkinsons sjukdom hos äldre som använder nätverksbaserad statistik. Conf Proc IEEE Eng med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergillos fall-dödlighet: systematisk granskning av litteraturen. Clin Infektera Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogenes av Aspergillus fumigatus vid invasiv aspergillos. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Kliniska manifestationer och behandlingsresultat av pulmonell aspergillom. Koreanska J Praktikant Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Det kliniska spektrumet av pulmonell aspergillos. Bröstkorg. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Jämförelse av epidemiologiska, kliniska och biologiska egenskaper hos invasiv aspergillos hos neutropeniska och nonneutropeniska patienter: en 6-årig undersökning. Clin Infektera Dis. 2006;43:577-584.
12. Han är en av de mest kända. Aspergillus galaktomannan enzymimmunanalys och kvantitativ PCR för diagnos av invasiv aspergillos med bronkoalveolär sköljvätska. J Clin Microbiol. 2004;42:5517-5522.
13. Vete LJ, Walsh TJ. Diagnos av invasiv aspergillos genom galaktomannan antigenemia detektion med användning av en enzymimmunanalys. Eur J Clin Microbiol Infektera Dis. 2008;27:245-251.
14. Han är en av de mest kända. Invasiv aspergillos hos kritiskt sjuka patienter utan malignitet. Am J Respir Crit Vård Med. 2004;170:621-625.
15. Sherif R, Segal BH. Pulmonell aspergillos: klinisk presentation, diagnostiska tester, hantering och komplikationer. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Vorikonazol kontra amfotericin B för primär behandling av invasiv aspergillos. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Kaspofungin kontra liposomalt amfotericin B för empirisk antimykotisk behandling hos patienter med ihållande feber och neutropeni. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungin (FK463), ensamt eller i kombination med andra systemiska antifungala medel, för behandling av akut invasiv aspergillos. J Infektera. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavukonazol: ett nytt alternativ för hantering av invasiva svampinfektioner. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavukonazol kontra vorikonazol för primär behandling av invasiv mögelsjukdom orsakad av Aspergillus och andra filamentösa svampar (SECURE): en fas 3, randomiserad kontrollerad, non-inferiority-studie. Lancet. 2016;387:760-769.
21. Han är en av de mest kända. Behandling av invasiv aspergillos med posakonazol hos patienter som är eldfasta mot eller intoleranta mot konventionell terapi: en externt kontrollerad studie. Clin Infektera Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Liposomal amfotericin B (AmBisome) terapi vid invasiva svampinfektioner. Utvärdering av Förenade kungarikets medkännande användningsdata. Arch Praktikant Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Effekt och säkerhet för kaspofungin för behandling av invasiv aspergillos hos patienter som är eldfasta mot eller intoleranta mot konventionell antimykotisk behandling. Clin Infektera Dis. 2004;39:1563-1571.
24. Det finns många olika typer av musik. Posakonazol vs flukonazol eller itrakonazolprofylax hos patienter med neutropeni. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.